Fala Gás Nobre, vamos falar hoje sobre a estrutura da tabela periódica, essa importante ferramenta que nos fornece inúmeras informações sobre todos os elementos que a constituem.
Nós já falamos aqui no blog sobre a história da tabela periódica, desde a primeira teoria dos elementos até a tabela que conhecemos atualmente.
Leia mais em: A História da Tabela Periódica
Mendeleev publicou em 1869 uma tabela que viria ser precursora da tabela que conhecemos hoje em dia. Seu trabalho era rico em informações, chegando até mesmo a prever a existência de elementos ainda não descobertos.
No entanto, sua tabela era organizada a partir da massa atômica dos elementos, enquanto a atual é organizada a partir do número atômico. Vale ressaltar que a descoberta do número atômico aconteceu mais de 40 anos após a tabela publicada por Mendeleev.
Em 1913, o físico inglês Henry Moseley reformulou a tabela periódica de acordo com o número atômico dos elementos. Foi Moseley que descobriu a existência de um número atômico (Z), isto é, do número de prótons presente em cada elemento.
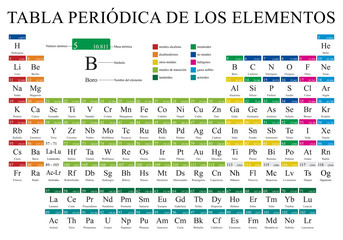
Mas como é que a tabela periódica atual é estruturada?
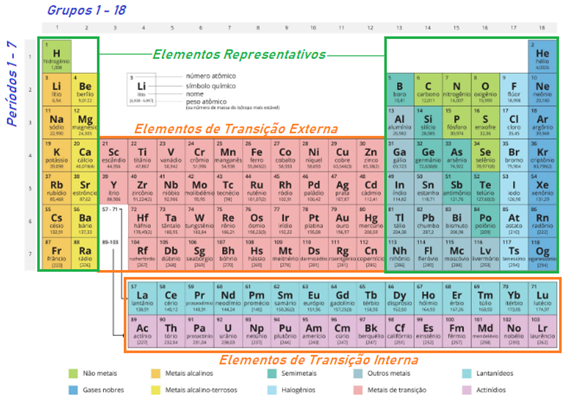
A Tabela Periódica atual é organizada em linhas horizontais em ordem crescente de número atômico, sendo o hidrogênio, o elemento de menor número atômico (Z = 1), o primeiro elemento da tabela.
Como previsto por Mendeleev em 1869, os elementos apresentavam propriedades semelhantes em intervalos regulares. Estes elementos de propriedades semelhantes foram organizados em colunas na tabela.
Denominamos cada linha da tabela de período e cada coluna de grupo ou família. Elementos que pertencem a mesma linha ou coluna, apresentam propriedades semelhantes.
Os da mesma linha apresentam características de tamanho semelhantes e o mesmo número de camadas eletrônicas. Já os da mesma coluna apresentam características de reatividade semelhante.
Colunas: Grupos ou Famílias
São denominados assim, pois membros de uma família tendem a apresentarem características semelhantes entre si. Na tabela também ocorre isso, elementos do mesmo grupo ou família apresentam propriedades físicas e químicas semelhantes.
Isso acontece porque os elementos de uma mesma família possuem o mesmo número de elétrons na sua camada de valência, isto é, na sua última camada eletrônica.
Segundo a União Internacional da Química Pura e Aplicada (IUPAC), as famílias/grupos devem ser ordenadas de 1 a 18.
Por exemplo, na família 1, todo os membros possuem 1 elétron na camada de valência, já na família 2, todos possuem 2, na 13 todos possuem 3, e assim sucessivamente da família 14 (4 elétrons) até a família 18 (8 elétrons).
Algumas destas famílias possuem nomes bastante difundidos que são utilizados até hoje, que são: Metais alcalinos (família 1), metais alcalino terrosos (família 2), calcogênios (família 16), halogênios (família 17) e gases nobres (família 18).
Esses nomes foram atribuídos a estas famílias devido a características que os seus elementos possuem, como obtenção e reatividade.
A tabela é dividida em 2 subgrupos de elementos, os chamados elementos representativos e os elementos de transição (externa e interna).
Os elementos representativos se encontram nas famílias, 1, 2 e de 13 à 18. Sendo representados nas extremidades esquerda e direita da tabela.
São os elementos mais presentes na maioria dos compostos e, portanto, os mais estudados no ensino médio. Todos estes elementos possuem seu elétron mais energético situado em subníveis ‘s’ ou ‘p’ da sua camada de valência.
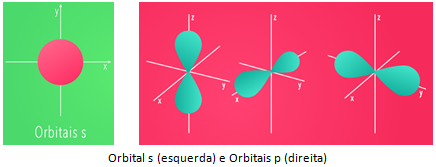
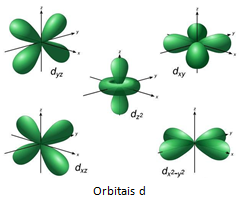
Já os elementos de transição se encontram nas famílias de 3 à 12. Sendo representados na região central da tabela. Todos estes elementos possuem seu elétron mais energético situado no subníveis ‘d’ ou ‘f’ da sua camada de valência.
Leia mais em: Números Quânticos: O que são?
Eles podem ser ainda classificados em elementos de transição externa e elementos de transição interna.
Os de transição externa possuem como último subnível de energia orbitais ‘d’. Sendo representados pelos metais mais conhecidos, como: Ouro, prata, ferro, cobre, estanho, zinco, entre outros.
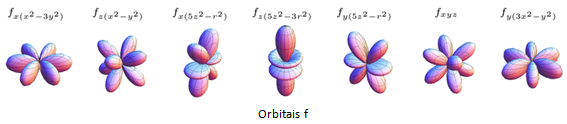
Já os de transição interna estão localizados abaixo do corpo principal da tabela periódica, pertencentes a 2 séries de elementos, os Actinídeos e os Lantanídeos. Seus elétrons mais energéticos ficam localizados em um subnível de obital ‘f’.
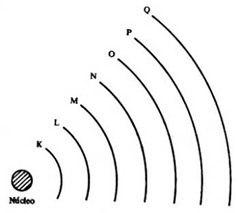
Já as linhas da tabela, também chamadas de períodos, indicam a quantidade de camadas eletrônicas que os átomos dos elementos de cada linha possuem.
Por exemplo, o hidrogênio (H) e o hélio (He), que pertencem à primeira linha da tabela, possuem elétrons apenas na camada K. Já o cloro (Cl), que se encontra no 3º período (linha) possuí elétrons nas camadas K, L e M. Assim acontece sucessivamente até o 7º período da tabela, onde os elementos irão possuir elétrons em todas as 7 camadas eletrônicas.
Leia mais em: Distribuição Eletrônica: Entenda como fazer
Desta forma a tabela periódica se torna uma rica fonte de informações sobre os átomos de cada um dos 118 elementos químicos conhecidos.
Com a tabela periódica podemos também prever e extrair dados de inúmeras propriedades chamadas de propriedades periódicas. Isto é, que variam de acordo com a localização dos elementos na tabela.
Leia mais em:
O que é a tabela periódica e como utilizá-la?
Exercícios sobre classificação dos elementos na tabela
Algumas destas propriedades são: a densidade, o raio atômico, a eletronegatividade, a temperatura de fusão, a reatividade, entre outras. Mas isso é tema para estudarmos em um próximo texto. Ficou interessado? Bora acompanhar o Ciência em Ação nas redes e ficar por dentro de tudo que postamos. Reage!
Referências: LIMA, G. M.; BARBOSA, L. C. A.; FILGUEIRAS, C. A. L. Origens e Consequências da Tabela Periódica, a mais concisa enciclopédia criada pelo ser humano. Química Nova. Vol 42, nº 10, pg 1125-1145, 2019.
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda nesse ano.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


