Fala Gás Nobre, hoje falaremos sobre geometria molecular, que é o formato que moléculas ocupam no espaço, de acordo com o número de ligações que realiza e o número de pares de elétrons que possui e não participam das ligações.
As geometrias moleculares que abordaremos hoje se referem a moléculas que possuem ligações covalentes, uma vez que os compostos iônicos apresentam geometrias cristalinas, que serão discutidas em outra oportunidade.
Desta forma, falaremos sobre as geometrias de moléculas com ligações covalentes que possuem um átomo central, baseando-se assim na teoria RPECV (Repulsão dos Pares de Elétrons da Camada de Valência).
Leia mais em:
Ligações Covalentes no nosso cotidiano: Parte I
Ligações Covalente no nosso cotidiano: Parte II
Essa teoria, RPECV ou VESPR (pronuncia-se vésper), do inglês Valence Shell Electron Pair Repulsion foi formulada pelos químicos Ronald J. Gillespie (1924- ) e Ronald D. Nyholm (1917 – 1971) em 1957.
Leia mais em: Conceitos e Teoria RPECV: O que você precisa saber
A Teoria da Repulsão dos Pares de Elétrons da Camada de Valência (RPECV) é um modelo químico que busca deduzir a geometria molecular de um composto por meio da repulsão eletrostática dos elétrons na camada de valência.
Leia mais em:
Aula: Geometria Molecular – Parte I
Estudo de Moléculas – Um resumo completo
A teoria parte da prerrogativa de que os pares de elétrons da última camada, ou seja, da camada de valência, se repelem. Tal repulsão faz com que estes pares de elétrons adotem conformações espaciais que minimizem essas repulsões, determinando, desta forma, sua geometria molecular.
Essa teoria nos fornece a geometria molecular dos compostos a partir do número de ligações e de pares de elétrons não ligantes que o átomo central possui, conforme tabela abaixo:

Exposto tudo isso, vamos falar de cada um dos tipos de geometria molecular e apresentar exemplos de compostos de cada uma delas.
Lembrando que a geometria é dada pelos ligantes, ou seja, átomos ligados ao átomo central da molécula, mas que é afetada pela repulsão dos pares de elétrons não ligantes deste mesmo átomo central.
Linear
Temos 3 tipos de compostos que podem apresentar geometria linear:
– Ligação covalente entre 2 elementos iguais ou diferentes:
(F2) F-F, (O2) O=O, (HCl) H-Cl, (HF) H-F
– Átomo central com 2 ligantes e sem pares de elétrons não ligantes: (CO2) O=C=O

– Átomo central com 2 ligantes e 3 pares de elétrons não ligantes: XeF2
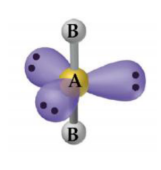
Angular
Temos 2 tipos de compostos que podem apresentar esse tipo de geometria:
– Átomo central com 2 ligantes e 1 par de elétrons não ligante: SO2, PbCl2.
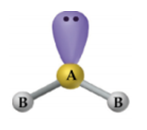
– Átomo central com 2 ligantes e 2 pares de elétrons não ligantes: H2O.
Trigonal Plana
– Átomo central com 3 ligantes e sem pares de elétrons não ligantes: BF3, AlCl3.

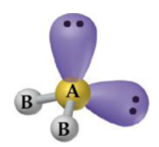
Piramidal
– Átomo central com 3 ligantes e 1 par de elétrons não ligantes: NH3, PH3.
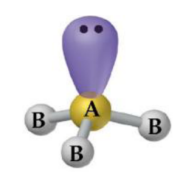
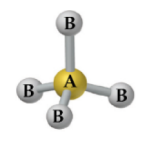
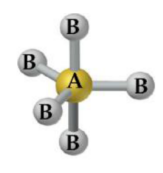
Tetraédrica
– Átomo central com 4 ligantes e sem pares de elétrons não ligantes: CH4, CCl4.
Forma de “T”
– Átomo central com 3 ligantes e 2 pares de elétrons não ligantes: BrF3, ClF3.

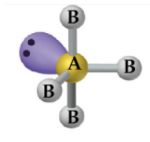
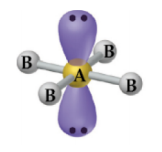
Gangorra
– Átomo central com 4 ligantes e 1 par de elétrons não ligantes: SF4, SeCl4.
Bipirâmide Trigonal
– Átomo central com 5 ligantes e sem pares de elétrons não ligantes: PCl5.
Quadrado Planar
– Átomo central com 4 ligantes e 2 pares de elétrons não ligantes: PtCl4, XeF4.
Pirâmide quadrada
– Átomo central com 5 ligantes e 1 par de elétrons não ligantes: BrF5.

Octaédrica
– Átomo central com 6 ligantes e sem pares de elétrons não ligantes: SF6.
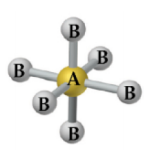
Beleza Gás Nobre, esse é um super resumo sobre geometria molecular, com estruturas, número de ligantes e de pares de elétrons não ligantes, além de exemplos de compostos que possuem cada uma destes geometrias aqui apresentadas. Bora ficar ninja nesse assunto. Reage!
Referências
SUSSUCHI, E. M.; SANTOS, D. O.; Teoria da Ligação de Valência (TLV) e Repulsão dos Pares de Elétrons da Camada de Valência (RPECV). CESAD/UFS, 2020.
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.




