Fala Gás Nobre, hoje veremos como resolver alguns exercícios sobre Geometria Molecular. Geometria Molecular é o formato que moléculas ocupam no espaço, de acordo com o número de ligações que realiza e o número de pares de elétrons que possui e não participam das ligações.
As geometrias moleculares que veremos nos exercícios de hoje se referem a moléculas que possuem ligações covalentes, uma vez que os compostos iônicos apresentam geometrias cristalinas, que serão discutidas em outra oportunidade.
Desta forma, falaremos sobre as geometrias de moléculas com ligações covalentes que possuem um átomo central, baseando-se assim na teoria RPECV (Repulsão dos Pares de Elétrons da Camada de Valência).
Leia mais em:
Ligações Covalentes no nosso cotidiano: Parte I
Ligações Covalente no nosso cotidiano: Parte II
Essa teoria, RPECV ou VESPR (pronuncia-se vésper), do inglês Valence Shell Electron Pair Repulsion foi formulada pelos químicos Ronald J. Gillespie (1924- ) e Ronald D. Nyholm (1917 – 1971) em 1957.
Leia mais em: Conceitos e Teoria RPECV: O que você precisa saber
A Teoria da Repulsão dos Pares de Elétrons da Camada de Valência (RPECV) é um modelo químico que busca deduzir a geometria molecular de um composto por meio da repulsão eletrostática dos elétrons na camada de valência.
Leia mais em:
Aula: Geometria Molecular – Parte I
Estudo de Moléculas – Um resumo completo
Esta teoria parte da prerrogativa de que os pares de elétrons da última camada, ou seja, da camada de valência, se repelem. Tal repulsão faz com que estes pares de elétrons adotem conformações espaciais que minimizem essas repulsões, determinando, desta forma, sua geometria molecular.
Essa teoria nos fornece a geometria molecular dos compostos a partir do número de ligações e de pares de elétrons não ligantes que o átomo central possui, conforme tabela abaixo:
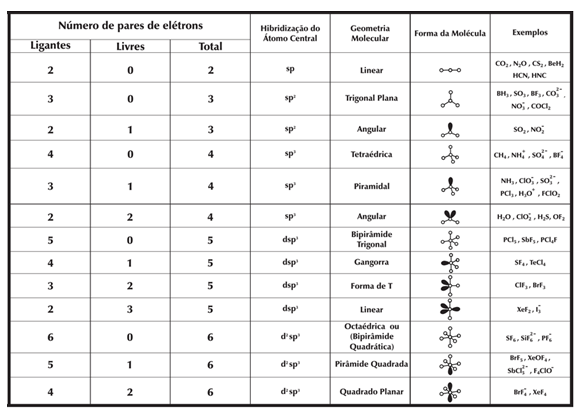
Lembrando que a geometria é dada pelos ligantes, ou seja, átomos ligados ao átomo central da molécula, mas que é afetada pela repulsão dos pares de elétrons não ligantes deste mesmo átomo central.
Gás Nobre, se você ainda está com dúvidas sobre este assunto não deixe de conferir esse Resumo Completo de Geometria Molecular e o artigo que escrevi sobre A Teoria RPECV, são 2 materiais que sem sombras de dúvidas vão te ajudar a melhor compreender e entender esse conteúdo.
Agora que já fizemos uma breve introdução teórica sobre geometria molecular, bora praticar?
01. (UFLA) O ângulo de ligação do metano (CH4) é 109,5ºC, o da amônia (NH3) é 107,0º e o da água (H2O) é 104,5ºC. Os ângulos de ligação, nessas moléculas, são diferentes em razão
a) de o ângulo de ligação depender da eletronegatividade do átomo central.
b) de o carbono, oxigênio e nitrogênio apresentarem pares de elétrons livres.
c) da diferença de hibridização de C, O, N.
d) do raio atômico dos átomos centrais.
e) de o oxigênio apresentar dois pares de elétrons livres (não-ligantes), o nitrogênio, um par de elétrons livres e o carbono, nenhum.
Resolução
Gás Nobre, aqui já vai minha primeira dica para resolver exercícios sobre geometria molecular, sempre faça a estrutura de Lewis da molécula fornecida pelo enunciado da questão, esse tipo de estrutura nos fornece quantos pares de elétrons ligantes e não-ligantes o átomo central possui. Através desta informação, pela Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência (RPECV), determinamos a geometria molecular da molécula em questão.
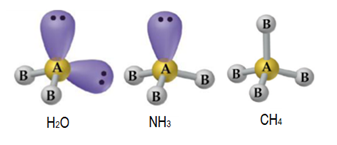
Depois de resolver vários exercícios sobre esse tema você vai acabar gravando e conhecendo a geometria das moléculas mais comuns, como água (H2O), amônia (NH3), gás carbônico (CO2), metano (CH4), entre outras. Mas por ora, vamos passo a passo.
De acordo com a tabela periódica, o oxigênio, o nitrogênio e o carbono (átomos centrais) contém respectivamente, 6, 5 e 4 elétrons na sua camada de valência, ou seja, irão se estabilizar, atingindo a configuração eletrônica de um gás nobre com 8 elétrons na camada de valência ao fazerem 2, 3 e 4 ligações, respectivamente.
Leia mais em: Regra do Octeto
O oxigênio fará 2 ligações (2 pares de elétrons ligantes) e permanecerá com 2 pares de elétrons não ligantes (4 pares = 8 elétrons), o nitrogênio fará 3 ligações (3 pares de elétrons ligantes) e permanecerá com 1 par de elétrons não ligantes (4 pares = 8 elétrons), por fim, o carbono faz 4 ligações, ou seja, possui apenas pares de elétrons ligantes. Conforme imagem abaixo:
Portanto, a melhor alternativa é a letra “e”.
Mas porque as demais alternativas estão incorretas?
a) ângulo de ligação independe da eletronegatividade e sim dos pares de elétrons (ligantes e não ligantes).
b) carbono não possui par de elétrons livres.
c) Todos os 3, oxigênio, nitrogênio e carbono possuem 4 pares de elétrons, entre
ligantes e não ligantes, ou seja, possuem mesma hibridização, sp³.
d) A diferença de raio atômico não influencia a geometria molecular, apenas a presença dos pares de elétrons (ligantes ou não).
Gabarito: E
02. (UFMT) A teoria da repulsão dos pares eletrônicos sustenta: ao redor do átomo central, pares eletrônicos ligantes e não ligantes se repelem, tendendo a ficar tão afastados quanto possível. De acordo com essa teoria, quais estruturas podem ser previstas para as moléculas de SF6, PCl5, CH4, respectivamente?
a) tetraédrica, bipirâmide trigonal e octaédrica.
b) octaédrica, bipirâmide trigonal e tetraédrica.
c) bipirâmide trigonal, tetraédrica e octaédrica.
d) tetraédrica, tetraédrica e octaédrica.
e) octaédrica, tetraédrica e bipirâmide trigonal.
Resolução
Gás Nobre, nos compostos citados no enunciado da questão temos como átomos centrais o enxofre (S), o fósforo (P) e o carbono (C). De acordo com a tabela periódica estes elementos possuem, respectivamente, 6, 5 e 4 elétrons na sua camada de valência. O enxofre está fazendo ligação com 6 átomos de flúor e o fósforo com 5 átomos de cloro, ou seja, ambos estão compartilhando todos seus elétrons e consequentemente ficando com mais de 8 elétrons (4 pares) na sua camada de valência, sendo assim, exceções a regra do octeto. O carbono também está compartilhando todos os seus elétrons, logo, nenhum destes compostos possuem pares de elétrons não ligantes.
Leia mais em: A tabela periódica
De acordo com a tabela contendo todos as geometrias moleculares, compostos sem pares de elétrons não ligantes e com 6, 5 e 4 pares de elétrons ligantes, possuem, respectivamente, geometria octaédrica, bipirâmide trigonal e tetraédrica, conforme figura abaixo:
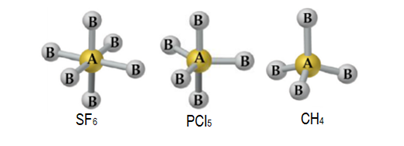
Portanto, a alternativa correta é a letra b) octaédrica, bipirâmide trigonal e tetraédrica.
Gabarito: B
03. (ESPCEX) O íon nitrato (NO3–), a molécula de amônia (NH3), a molécula de dióxido de enxofre (SO2) e a molécula de ácido bromídrico (HBr) apresentam, respectivamente, a seguinte geometria:
a) piramidal; trigonal plana; linear; angular.
b) trigonal plana; piramidal; angular; linear.
c) piramidal; trigonal plana; angular; linear.
d) trigonal plana; piramidal; trigonal plana; linear.
e) piramidal; linear; trigonal plana; tetraédrica.
Resolução
Gás Nobre, vamos determinar a geometria de cada uma destas moléculas uma a uma. O HBr possui apenas uma ligação entre o átomo de hidrogênio e o átomo de bromo, logo, sua geometria só pode ser linear (H – Br).
O SO2 tem como átomo central o enxofre (S), que possui 6 elétrons na camada de valência, na molécula de SO2, ele reage com 2 átomos de oxigênio, que também possuem 6 elétrons na camada de valência. Os oxigênio fazem 2 ligações cada com o átomo de enxofre, atingindo a estabilidade do octeto. Já o enxofre tem a capacidade de expandir o octeto e se estabilizar com mais de 8 elétrons na camada de valência, compartilhando 4 dos seus 6 elétrons, fazendo assim 4 ligações com oxigênios (2 com cada 1) e ficando com 1 par de elétrons não ligantes. De acordo com a tabela das geometrias moleculares, quando o átomo central está ligado a 2 átomos ligantes e possui 1 par de elétrons não ligantes, sua geometria é do tipo angular.
O nitrogênio, átomo central da amônia, possui 5 elétrons na camada de valência e compartilha 3 destes com os átomos de hidrogênio, ficando assim com 3 pares de elétrons ligantes e 1 par de elétrons não ligantes. De acordo com a tabela de geometria molecular, a sua geometria será do tipo piramidal.
Por fim, o íon NO3–, temos um átomo de nitrogênio com 5 elétrons na camada de valência ligado a 3 átomos de oxigênio. O nitrogênio compartilhará seus 5 elétrons, fazendo 2 ligações com 2 átomos de oxigênio e 1 ligação com o restante, como 1 dos átomos de oxigênio não fica com 2 ligações, a carga do íon é -1. Vale ressaltar que no íon NO3– ocorre um efeito chamado de “Ressonância”, onde a densidade de carga é distribuída entre as 3 ligações com oxigênios, tornando o íons mais estável. Como o nitrogênio está ligado a 3 átomos de oxigênio e não possui par de elétrons não ligante, sua geometria, de acordo com a tabela, será do tipo trigonal plana.
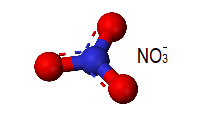
Logo, a alternativa correta é a letra b) trigonal plana, piramidal, angular e linear.
Gabarito: B
Leia mais em: Efeitos Indutivos: Resumão Completo
04. (ITA) Assinale a opção que contém a geometria molecular correta das espécies OF2, SF2, BF3, NF3, CF4 e XeO4, todas no estado gasoso.
a) Angular, linear, piramidal, piramidal, tetraédrica e quadrado planar.
b) Linear, linear, trigonal plana, piramidal, tetraédrica e tetraédrica.
c) Angular, angular, trigonal plana, piramidal, tetraédrica e tetraédrica.
d) Linear, angular, piramidal, trigonal plana, angular e tetraédrica.
e) Trigonal plana, linear, tetraédrica, piramidal, tetraédrica e quadrado planar.
Resolução
Gás Nobre, vamos verificar a geometria molecular destes compostos um a um. No OF2, temos o oxigênio, que possui 6 elétrons na camada de valência como átomo central, fazendo 1 ligação com cada átomo de flúor (que se estabiliza ao receber/compartilhar 1 elétron). Desta forma, o oxigênio possui 2 pares de elétrons compartilhados (ligantes) e 2 pares de elétrons (4 elétrons) não ligantes. Portanto, de acordo com a tabela, sua geometria será angular.
O SF2 se assemelha muito ao OF2, temos o enxofre como átomo central, que possui 6 elétrons na camada de valência e que compartilha 2 destes com átomos de flúor. Logo, sua geometria será a mesma que do OF2, portanto, angular.
No BF3 temos o boro (B) como átomo central, o boro possui 3 elétrons na sua camada de valência e os compartilha com 3 átomos de flúor, portanto, terá 3 pares de elétrons ligantes e nenhum par de elétrons não ligante. De acordo com a tabela, sua geometria será do tipo trigonal plana.
O NF3 se assemelha a molécula da amônia (NH3) que já vimos anteriormente. O nitrogênio possui 5 elétrons na camada de valência e compartilha 3 destes com átomos de flúor, ou seja, possui 2 elétrons não ligantes (1 par). De acordo com a tabela, ao possuir 3 pares ligantes e 1 não ligante, sua geometria será piramidal.
O CF4 se assemelha a molécula do metano (CH4), também vista anteriormente. Nesse composto o átomo de carbono compartilha todos seus 4 elétrons, fazendo 4 ligações. Logo, de acordo com a tabela, sua geometria é tetraédrica.
Por fim, o XeO4 representa um caso de expansão do octeto, onde o xenônio (Xe), um gás nobre, que já possui 8 elétrons na camada de valência, compartilha estes 8 elétrons com 4 átomos de oxigênio, fazendo assim 1 dupla ligação com cada um deles e ficando ausente de pares de elétrons não ligantes. Por possui 4 ligações e ausência de pares de elétrons não ligantes, sua geometria será tetraédrica.
Leia mais em: Gases Nobres: Tudo o que você precisa saber
Portanto, a alternativa correta é a letra c) Angular, angular, trigonal plana, piramidal, tetraédrica, tetraédrica.
Gabarito: c
05. (ITA – Adaptado) Assinale a opção que contém respectivamente a geometria das moléculas: AsH3 e SiCl4 no estado gasoso.
a) Trigonal Plana, quadrado planar
b) Piramidal, quadrado planar
c) Trigonal Plana, tetraédrica
d) Piramidal, piramidal
e) Piramidal, tetraédrica
Resolução
O AsH3 tem como átomo central o arsênio (As), que pertence a família XV da tabela periódica, ou seja, possui 5 elétrons na sua camada de valência dos quais 3 compartilha com 3 átomos de hidrogênio. Desta forma, possui 3 pares de elétrons ligantes e 1 par de elétrons não ligante, logo, de acordo com a tabela, sua geometria será do tipo piramidal.
Já o SiCl4 tem como átomo central o silício (Si), que pertence a mesma família que o carbono e portanto, possui 4 elétrons na sua camada de valência, o silício compartilha seus 4 elétrons com 4 átomos de cloro (Cl), possuindo assim 4 pares de elétrons ligantes e nenhum par de não ligantes. De acordo com a tabela sua geometria será tetraédrica.
Portanto, a alternativa correta é a letra e) Piramidal, tetraédrica.
Gabarito: E
Beleza Gás Nobre, espero que você tenha compreendido como resolver alguns exercícios envolvendo esse assunto, além é claro de identificar e descobrir a geometria molecular de diversos compostos químicos. Reage!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.




