Fala Gás Nobre, hoje vamos ver alguns exercícios resolvidos sobre ligações químicas e nox (número de oxidação). Bora reagir.
Leia mais em:
Teoria das Colisões
Exercícios Práticos sobre Ligações Químicas
Exercício 1
(MACK) Da fórmula eletrônica na figura adiante, pode-se concluir que:
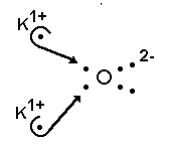
a) o potássio pertence à família dos metais alcalino-terrosos.
b) o átomo de oxigênio tem seis elétrons na camada de valência e, ao ligar-se, adquire uma configuração eletrônica igual à de um gás nobre.
c) ocorre somente uma ligação iônica.
d) a substância formada não é eletricamente neutra.
e) o átomo de oxigênio cede dois elétrons para dois átomos de potássio.
Resolução – Exercício 1
Na imagem podemos observar que:
- Potássio possui carga +1, ou seja, pertence à família dos metais alcalinos (1A);
- Ocorrem 2 ligações iônicas;
- A substância formada é eletricamente neutra (+1 +1 -2 = 0);
- Cada átomo de potássio cede 1 elétron para o oxigênio;
- Oxigênio possui carga 2-, ou seja, possui 6 elétrons na camada de valência.
Desta forma, a alternativa correta é a letra B, pois o oxigênio possui 6 elétrons na camada de valência e recebe 1 elétron de cada potássio, adquirindo assim configuração eletrônica igual à de um gás nobre (8 elétrons).
Gabarito: B
Leia mais em: Ligações Iônicas no nosso cotidiano
Exercício 2
(UERJ) Para fabricar um dispositivo condutor de eletricidade, uma empresa dispõe dos materiais na tabela abaixo:
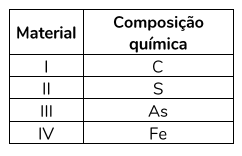
Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os responsáveis por essa propriedade. Assim, o material mais eficiente para a fabricação do dispositivo é representado pelo seguinte número:
a) I
b) II
c) III
d) IV
Resolução – Exercício 2
Como o enunciado do exercício diz, a empresa deseja fabricar um dispositivo condutor de eletricidade e que materiais metálicos possuem esta propriedade devido aos elétrons livres em sua estrutura, portanto, devemos escolher dentre os 4 materiais da tabela o que é um metal.
C (carbono), S (enxofre) e As (arsênio) são classificados como não-metais na tabela periódica da UERJ, sendo então o Fe(ferro) o único material metálico.
Gabarito: D
Leia mais em: Ligações Metálicas no nosso cotidiano
Exercício 3
(UEPG) A formação de ligações covalentes pode ser descrita em termos de interpenetração de orbitais que, de acordo com a orientação espacial, origina ligações covalentes dos tipos sigma e pi. Avalie os compostos a seguir quanto à presença de ligações covalentes sigma e pi e assinale o que for correto.
I) N2
II) H2CO3
III) Cl2
01. No composto I, há 1 ligação sigma e 2 ligações pi.
02. No composto III, há 2 ligações sigma.
04. No composto III, há 1 ligação pi.
08. No composto II, há 3 ligações pi.
16. No composto II, há 5 ligações sigma.
Resolução – Exercício 3
O nitrogênio pertence ao grupo 15, isto é, possui 5 elétrons na camada de valência e pode fazer 3 ligações. Desta forma, o N2 é formado por 2 átomos de nitrogênio (N) ligados entre si por uma ligação tripla, ou seja, por 1 ligação sigma e 2 ligações pi.
O H2CO3, conforme figura abaixo, faz 1 ligação dupla entre o carbono e o oxigênio e quatro simples entre o carbono e os demais oxigênios e entre um hidrogênio ligado a cada oxigênio. Ou seja, o composto possui 5 ligações sigma e 1 pi.
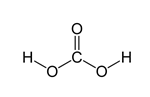
O cloro pertence ao grupo 17, isto é, possui 7 elétrons na camada da valência e pode fazer 1 ligação para atingir a configuração eletrônica de um gás nobre. O Cl2 é uma molécula onde 2 átomos de cloro compartilham elétrons através de uma ligação simples, ou seja, do tipo sigma.
Desta forma, estão corretas apenas as afirmações 01 e 16.
Gabarito: 17
Leia mais em:
Ligações Covalentes no nosso cotidiano: Parte I
Ligações Covalente no nosso cotidiano: Parte II
Exercício 4
(UFU) As substâncias SO2, NH3, HCl e Br2 apresentam as seguintes interações intermoleculares, respectivamente:
a) dipolo-dipolo, ligação de hidrogênio, dipolo-dipolo e dipolo induzido-dipolo induzido.
b) dipolo instantâneo-dipolo induzido, dipolo-dipolo, ligação de hidrogênio e dipolo-dipolo.
c) dipolo-dipolo, ligação de hidrogênio, ligação de hidrogênio e dipolo-dipolo.
d) forças de London, dipolo-dipolo, ligação de hidrogênio e dipolo induzido-dipolo induzido.
Resolução – Exercício 4
Primeiro, temos que identificar a polaridade dos compostos e o tipo de interações intermoleculares realizadas por eles.
O SO2 é uma molécula de geometria angular e o oxigênio e o enxofre apresentam diferença de eletronegatividade, portanto, trata-se uma molécula polar.
A NH3 é uma molécula de geometria piramidal e apresenta diferença de eletronegatividade entre nitrogênio e hidrogênio, portanto, trata-se de uma molécula polar. A NH3 também possui hidrogênios ligados à átomos do tipo FON (Flúor, Oxigênio, Nitrogênio), ou seja, possui interações intermoleculares do tipo ligação de hidrogênio.
O HCl é uma molécula de geometria linear mas que apresenta diferença de polaridade entre o átomo de hidrogênio e o de cloro, ou seja, trata-se de uma molécula polar.
O Br2 é uma molécula linear formada pela ligação entre 2 átomos de bromo, ou seja, não possui diferença de polaridade, portanto, apolar.
Moléculas polares realizam interações do tipo dipolo-dipolo, enquanto as apolares realizam do tipo dipolo induzido – dipolo induzido. Já as que possuem átomos de hidrogênio ligados a átomos do tipo FON, fazem ligações de hidrogênio.
Portanto, a resposta correta é a alternativa A.
Gabarito: A
Leia mais em:
Aula: Ligações Químicas – Fórmulas Estruturais
Aula: Ligações Químicas – Forças Intermoleculares
Exercício 5
(UEM) Os números de oxidação dos átomos Sb, Br, Ir, Fe, C e P, nos compostos Sb4O10, BrO4–, IrCl6–, Na2Fe2O4, CaC2O4 e HPO32-, serão, respectivamente,
a) +5, +7, +5, +3, +3 e +3.
b) -5, +5, +5, +3, -3 e +3.
c) +5, +7, +5, +2, +3 e +1.
d) +7, -5, +5, -4, +2 e -4.
e) -5, -7, -5, -3, -3 e -3.
Resolução – Exercício 5
Alguns elementos tendem a não variar seu número de oxidação e é a partir destes que calculamos o nox dos elementos que possuem mais de 1 número de oxidação. Alguns exemplos destes elementos que não sofrem variação, são:
Família IA: Nox = 1+ (Na, K, Li)
Família IIA: Nox = 2+ (Ca, Mg)
Oxigênio: Nox = 2- (Há excessões.)
Hidrogênio: Nox = 1+ (Exceto nos hidretos metálicos).
Sb4O10
Temos 10 átomos de oxigênio com nox igual a 2-. Multiplicamos o número de oxigênios pela sua carga e obtemos o total de cargas negativas da molécula. Como a molécula é neutra, o número de cargas positivas deve ser igual, ou seja, se 10 oxigênios possuem carga -20, 4 Sb possuem carga 20+. Desta forma, o nox do Sb é igual a +5 (20/4 = 5).
BrO4–
De forma análoga, temos 4 oxigênios, que vão resultar em uma carga 8-, no entanto, a molécula já possui uma carga negativa, ou seja, a carga positiva do bromo é 1 unidade menor do que a carga negativa dos oxigênios. Ou seja, +7.
IrCl6–
De forma semelhante ao composto anterior, a carga do Irídio é 1 unidade menor do que a carga negativa dos átomos de cloro. Cada cloro possui -1, totalizando -6, ou seja, carga do Irídio é igual a +5.
Na2Fe2O4
Neste caso, temos um átomo central, então precisamos contabilizar as cargas negativas do oxigênio e as positivas do sódio. Cada oxigênio possui carga 2- (8-) e cada sódio 1+ (2+), somando as duas, temos 6-. Ou seja, a carga de 2 átomos de ferro é igual a +6, sendo +3 o nox de cada átomo de ferro.
CaC2O4
De forma semelhante, temos 8- dos oxigênios e 2+ do átomo de cálcio, sendo que a carga a ser equilibrada pelos átomos de carbono igual a -6. Ou seja, a carga de 2 átomos de carbono é igual a 6+, sendo 3+ o nox de cada átomo de carbono.
HPO32-,
De forma semelhante, carga dos oxigênios (6-), carga do hidrogênio (1+), carga total da molécula (2-), ou seja, o átomo de fósforo possui 2 unidades a menos que a necessária para que a molécula tenha carga nula. Logo, o nox do fósforo é 3+.
A alternativa que contém os nox destes elementos nestes compostos é a letra A.
Gabarito: A
Leia mais em:
Aula de Química Geral: Nox, Oxirredução e Balanceamento
Exercícios sobre Oxidação e Redução
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.




