Fala Gás Nobre, você certamente deve conhecer ou pelo menos já ter visto ou ouvido falar da tabela periódica, mas será se ela foi sempre do jeitinho que a conhecemos? Hoje vamos falar um pouco da história da tabela periódica dos elementos químicos.
A tabela periódica atual é um modelo de representação que conta com os 118 elementos químicos conhecidos e nos fornece inúmeras propriedades destes elementos, chamadas de propriedades periódicas.
O modelo da tabela periódica que conhecemos atualmente foi inicialmente proposto pelo químico russo Dmitri Mendeleev (1834 – 1907), no ano de 1869.
O ano de 2019 foi estabelecido pela Organização das Nações Unidas (ONU) como o Ano Internacional da Tabela Periódica, em comemoração aos 150 anos da publicação da primeira tabela periódica feita por Mendeleev.
O intuito inicial de se criar uma tabela era o de facilitar a organização, a classificação e o agrupamento dos elementos conforme suas propriedades.
Leia mais em:
O que é a tabela periódica e como utilizá-la?
Exercícios sobre classificação dos elementos na tabela
Diversos estudiosos vinham tentando organizar estes elementos de acordo com suas propriedades, alguns deles até mesmo apresentando listas e tabelas. Mas foi Mendeleev o primeiro a apresentar uma tabela bem organizada e que previa até a existência de elementos que sequer haviam sido descobertos ainda.
As primeiras tentativas de organizar os elementos data da Grécia Antiga. Foi o filósofo grego Empédocles (495a.C. – 430a.C.) que atribuiu a teoria dos 4 elementos naturais conhecidos atualmente, água, o ar, o fogo e a terra.
Acreditava que tudo era formado a partir da mistura destes elementos. E que algumas propriedades eram obtidas a partir das misturas destes elementos, como: úmido(ar + água), seco(fogo + terra), quente(ar + fogo) e frio(água + terra). Criou-se símbolos para estes 4 elementos, conforme a figura abaixo:
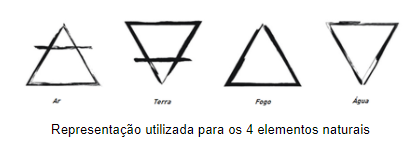
O conceito destes elementos e o uso de seus símbolos foram tão difundidos que até hoje se utiliza o símbolo do fogo (triângulo) para representar quando uma reação química precisa de aquecimento.
No entanto, apenas em 1789, mais de 2000 anos após a teoria dos 4 elementos de Empédocles, que Lavoisier, famoso cientista francês, publicou uma lista contendo 33 elementos químicos.
Nesta lista continha substâncias separadas em 5 distintos grupos, prevendo até mesmo a descoberta futura de outros elementos, no entanto, não foi capaz de estabelecer uma propriedade que os diferenciasse entre si.
Vale ressaltar que nessa lista ainda acreditava-se que a luz e o calórico eram elementos. Hoje em dia eles não são mais reconhecidos, assim como os 4 elementos de Empédocles.
Em 1829, o químico alemão Johann W. Döbereiner (1780-1848) sugeriu uma organização baseada em tríades. Isto é, agrupamentos de 3 elementos, onde a massa atômica do elemento do meio seria a média da soma das massas atômicas dos outros 2 elementos.
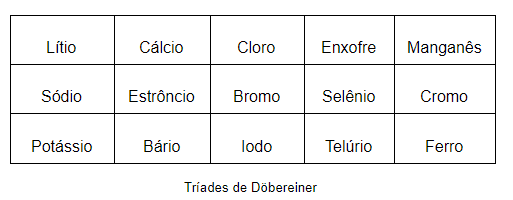
Entretanto, diversos elementos ficavam de fora deste tipo de organização.
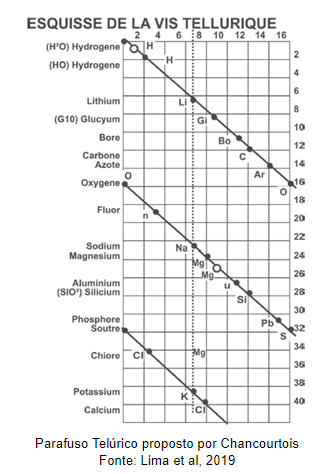
Já em 1862, o geólogo francês, Alexandre Émile B. de Chancourtois (1820-1886), organizou 16 elementos químicos por ordem crescente de massa atômica.
Chancourtois utilizou-se de um modelo que ficaria conhecido como Parafuso Telúrico (vis tellurique, vis: parafuso em francês, tellurique: Terra em latim). Neste modelo os elementos eram distribuídos ao longo da superfície de um cilindro em uma reta crescente de 45º de inclinação. Sendo alinhados verticalmente com os elementos que possuíam propriedades semelhantes.
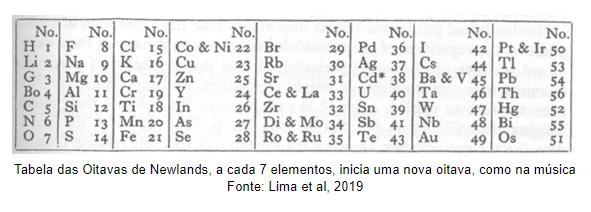
Em 1865, o químico inglês, John A. R. Newlands (1837-1898), criou a chamada Lei das Oitavas para os elementos químicos.
Newlands observou que os elementos apresentavam propriedades características e que estas tinham relação com a sua massa atômica. Observou também que estas propriedades se repetiam a cada 8 elementos.
Por possuir uma relação com a música, organizou esses grupos de 8 elementos se baseando nas oitavas musicais. O que fez com que fosse duramente criticado pela Sociedade de Química da Inglaterra (Royal Society) na época. Newlands teve seu trabalho reconhecido apenas em 1887, após o sucesso da tabela de Mendeleev.
Em 1868, o químico alemão Lothar Meyer (1830-1895), baseando-se em propriedades físicas dos elementos, esboçou uma tabela baseada na relação entre a massa atômica e a propriedade dos elementos.
Meyer fez algumas correções na sua tabela e a publicou em 1870, 1 ano após a publicação da tabela de Mendeleev. Meyer chegou a comentar que ambas as tabelas eram capazes de fornecer o mesmo tipo de informação, mas nunca fez questão de reclamar para si qualquer originalidade ou autoria.
Por fim, chegamos em 1869, ano da publicação da tabela precursora da que nós conhecemos atualmente. Dmitri Mendeleev, na Rússia, teve a mesma ideia que Meyer na Alemanha, no entanto, sua tabela foi publicada primeiro e havia sido elaborada de forma muito mais meticulosa.
Mendeleev havia deixado espaços vazios onde acreditava que pertenciam a elementos que ainda não haviam sido descobertos. Com a sua tabela ele foi capaz até de prever com certa precisão as propriedades dos elementos ainda não descobertos.

A tabela de Mendeleev era organizada a partir da massa atômica e era até então, o trabalho mais completo publicado nesta área. Seu trabalho permitiu que se obtivessem informações de elementos de maneira simples e possibilitou a previsão da descoberta de novos elementos a partir destas propriedades.
Pouco se conhecia sobre os átomos naquela época, mas as ideias de Meyer-Mendeleev serviram de base para a tabela periódica atual.

Apenas em 1913, com o estabelecimento do conceito de número atômico, a partir das descobertas realizadas por Henry Moseley (1887-1915), que a tabela passa a ser organizada a partir do número atômico dos elementos.
Moseley reorganizou a tabela proposta por Mendeleev, a partir do número atômico dos elementos, adicionando os novos elementos que haviam sido descobertos, chegando numa tabela próxima a da atual.
Todos estes modelos nos mostram que a ciência é uma construção, onde todos contribuíram de alguma forma para o modelo atual da tabela.
A tabela atual conta com 118 elementos químicos, sendo os elementos 113-Nipónio, 115-Moscóvio, 117-Tenesso e 118-Organessônio os últimos a serem descobertos, e reconhecidos pela IUPAC somente em 2015.

Leia mais em: Novos Elementos da Tabela Periódica
Referências: LIMA, G. M.; BARBOSA, L. C. A.; FILGUEIRAS, C. A. L. Origens e Consequências da Tabela Periódica, a mais concisa enciclopédia criada pelo ser humano. Química Nova. Vol 42, nº 10, pg 1125-1145, 2019.
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda nesse ano.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


