Fala Gás Nobre, você sabia que alguns elementos formam mais de uma substância simples? E que a esse fenômeno atribuímos o nome de alotropia?
A palavra alotropia vem do grego ἄλλος (állos), “outro, diferente”, e -τροπος (tropos), “maneira”, ou seja, “maneira diferente” e foi uma denominação atribuída pelo químico Berzelius ao fenômeno em que um mesmo elemento químico pode originar duas ou mais substâncias simples diferentes.
Alguns dos elementos químicos que possuem alótropos são o oxigênio, o fósforo, o enxofre e o carbono, sendo este último detentor de um grande número de alótropos conhecidos.
Uma substância simples é aquela que possui apenas um elemento químico em sua composição, como por exemplo, o ferro (Fe), o ouro (Au), a prata (Ag), o gás cloro (Cl2), o gás nitrogênio (N2) e o gás oxigênio (O2).
Leia mais em: Substâncias Puras e Misturas
No entanto, alguns elementos podem formar mais de uma substância simples, variando o número de átomos presentes ou sua estrutura cristalina, estas diferentes substâncias de um mesmo elemento chamamos de alótropos.
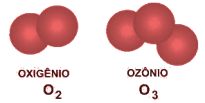
Temos um exemplo de alotropia entre o gás oxigênio (O2), presente em nossa atmosfera e vital para nossa respiração e o gás ozônio (O3), constituinte da camada que leva seu nome, a camada de ozônio e responsável pela proteção do planeta contra a radiação solar ultravioleta.
Outro elemento que possui alótropos é o fósforo (P), podendo ser encontrado nas cores preto, violeta, vermelho e branco, sendo as duas últimas suas versões mais conhecidas. O fósforo branco (P4) pode ser convertido ao vermelho através de aquecimento ou ao preto aplicando-se altas pressões, conforme a imagem abaixo:
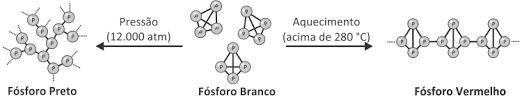
O fósforo vermelho (Pn), é formado por uma longa cadeia de fósforos ligados entre si, é estável e pouco reativo, sendo utilizado nas superfícies de atrito das caixas de fósforos de cozinha, sim Gás Nobre, o fósforo está presente na lateral da caixinha, na cabeça do palito de fósforo temos um composto de fósforo, o P4S3, no entanto, este não se trata de um alótropo.
Já o fósforo branco (P4), é formado por moléculas de 4 átomos de fósforo ligados entre si, sendo extremamente reativo, reage até mesmo com o oxigênio presente no ar, por isso, é armazenado em frascos contendo água. Devido a sua reatividade, é utilizado na fabricação de bombas incendiárias.
O enxofre também possui variações alotrópicas, no entanto, estas possuem o mesmo número de átomos, mas diferem na sua estrutura cristalina. Ambas possuem 8 átomos de enxofre (S8), mas enquanto uma apresenta cristais monoclínicos a outra apresenta cristais rômbicos.
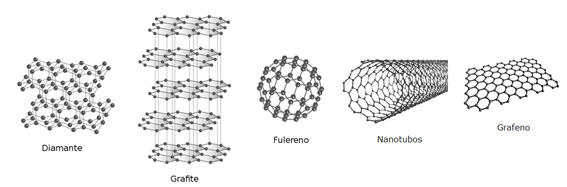
Já o carbono, até 1985 possuía apenas 2 alótropos conhecidos, o grafite e o diamante, que possuem propriedades físicas bem distintas, enquanto um é quebradiço o outro trata-se da substância com a maior dureza conhecida, sendo utilizado até mesmo como broca para perfurar outros minerais e rochas.
Essa diferença entre a dureza dos alótropos do carbono ocorre devido à organização estrutural de cada um, pois enquanto o grafite apresenta apenas lâminas de carbono fracamente interagindo entre si, o diamante possui uma estrutura compacta, o que gera tamanha resistência do material.
No entanto, em 1985 uma nova forma alotrópica do carbono foi descoberta, o fulereno (C60), cuja estrutura lembra a de uma bola de futebol. Atualmente, encontram-se fulerenos com C70, o C76, o C84, o C92 e o C540 e devido a suas características e propriedades físico-químicas únicas, tem ampla aplicação na bioquímica e na medicina.
Com a descoberta dos fulerenos e estudos com os mesmos, uma nova classe de alótropos do carbono foi descoberta, a dos nanotubos de carbonos, que são estruturas de carbono de tamanho na ordem de 10-9 metros enroladas quimicamente no formato de tubos. Esses nanotubos possuem um enorme potencial de aplicações no campo da nanotecnologia, eletrônica e óptica.
E por fim, mas não menos importante, temos o grafeno, a última forma cristalina do carbono descoberta, trata-se de uma folha plana de átomos de carbono densamente compactados e ligados entre si. O grafeno é quase transparente, muito leve e extremamente forte, além de ser um excelente condutor de calor e eletricidade. É utilizado como ingrediente para obtenção de materiais de grafite tridimensionais, como fulerenos e nanotubos.
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


