Fala Gás Nobre, hoje eu quero que você aprenda a fazer os Cálculos da Eletrólise. Esse é um dos conteúdos de química em que muitos alunos possuem dificuldades, portanto, vamos aprender passo a passo. Bora reagir?
Como já citado aqui no blog, a eletroquímica estuda a relação entre corrente elétrica e reações químicas. A eletrólise é um ramo de estudo da eletroquímica, pois se trata de uma conversão de energia elétrica em energia química.
A eletrólise é um processo não-espontâneo de descarga de íons, no qual, se fornece energia elétrica, fazendo com que o cátion receba e o ânion doe elétrons, de modo que ambos acabem por ficar com carga elétrica nula e com energia química acumulada.
Para que o processo de eletrólise ocorra, faz-se necessário a submissão de passagem de corrente elétrica em:
– Líquido iônico (Substância iônica fundida);
Ou
– Solução iônica (Substância iônica em meio aquoso);
Portanto, a eletrólise só ocorre na presença de íons livres.
Existem 2 tipos de eletrólise, a ígnea, que ocorre na ausência de água, ou seja, através de um composto iônico fundido e a eletrólise em meio aquoso, que ocorre em uma solução iônica.
Eletrólise Ígnea
Observe o esquema abaixo:
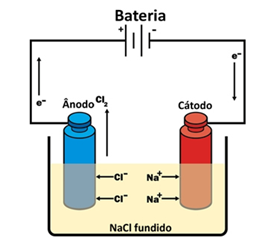
No esquema acima, temos NaCl fundido (T = 800,4ºC):
NaCl → Na⁺ + Cl⁻
O recipiente onde ocorre a eletrólise chama-se cuba eletrolítica, onde se encontram 2 eletrodos feitos de materiais condutores e inertes (que não participam da reação). Um dos eletrodos é ligado ao polo positivo e outro no negativo de uma fonte de energia.
A fonte produz uma variação de potencial que será descarregada nos íons que se encontram na cuba. Os ânions são atraídos pelo ânodo (carregado positivamente), e ao se oxidarem fornecem elétrons que irão para o cátodo (carregado negativamente), onde os cátions atraídos sofrerão redução.
Assim sendo, temos as reações químicas envolvidas no processo:
Dissociação: 2 NaCl → 2 Na⁺ + 2 Cl⁻
No ânodo (oxidação): 2 Cl⁻ → Cl₂ + 2 e⁻
No cátodo (redução): 2 Na⁺ + 2 e⁻ → 2 Na
Reação global: 2 NaCl → 2 Na + Cl₂
Analisando a diferença de potencial (ddp) gerada, temos um ddp negativo, ou seja, a reação não é espontânea, por isso necessita do fornecimento de energia com valor igual ou superior ao da ddp da reação.
Eletrólise em Meio Aquoso
Processo semelhante ao da eletrólise ígnea, no entanto, com a presença de água.
A água, ainda que fracamente, também sofre ionização, e seus íons formados também terão tendência a sofrerem oxirredução:
2 H₂O → H₃O⁺ + OH⁻
Acaba por observar-se que na eletrólise em meio aquoso:
– O cátion H3O+ possui prioridade em relação aos cátions de metais alcalinos, alcalino-terrosos e do alumínio.
– O ânion OH- possui prioridade em relação aos ânions oxigenados e do fluoreto.
Portanto, podem ocorrer três situações:
– Só o soluto sofre eletrólise;
– Parte do soluto e parte da água sofre eletrólise;
– Apenas o solvente sofre eletrólise.
A eletrólise possui diversas aplicações, como: obtenção de algumas substâncias que não são encontradas na natureza, como o gás hidrogênio (H2), através da eletrólise da água; purificação de alguns metais no seu estado bruto, como o cobre; galvanização de metais, como por exemplo, joias banhadas a ouro/prata ou zincagem de pregos de ferro.
Leia mais em:
Eletroquímica: Resumos e Exercícios
Aula: Eletroquímica – Eletrólise ígnea e aquosa
Agora que estamos feras em Eletrólise vamos ver como resolver alguns exercícios. Bora reagir?
Exercícios envolvendo intensidade e quantidade de carga
01. Calcule a intensidade de corrente que o gerador deve fornecer para que depois de 9 650s de passagem de corrente elétrica por uma solução de sulfato de cobre II (CuSO4) sejam liberados 6,35g de cobre no cátodo.
1º – Calcular o número de mols de elétrons necessários para realizar a deposição de massa especificada pelo exercício.
O cobre reduz de acordo com a seguinte reação: Cu²+ + 2e– → Cu0
Ou seja, para cada 1 mol de cobre reduzido se fazem necessários 2 mols de elétrons.
63,5 g de Cu – 2 mols de e–
6,35 g de Cu – x mols de e–
x = 0,2 mols de e–
2º – Calcular a quantidade de carga equivalente a quantidade de mols de elétrons encontrada.
A constante de Faraday, que define a carga de 1 mol de elétrons, é F = 96500 C.
1 mol de e– – 96500 C
0,2 mols de e– – x C
x = 19300 C
3º – Encontrar a intensidade de carga através da relação, Q = i . t
Q = quantidade carga (C)
i = intensidade de carga (amp)
t = tempo (seg)
Q = i . t
19300 C = i . 9650s
i = 19300 C/ 9650s
i = 2,0 A
Exercícios para identificação do cátodo e do ânodo da cuba eletrolítica
02. (UFOP MG) Um estudante resolveu folhear sua chave com prata, utilizando a seguinte montagem: Nessa célula, a chave corresponde ao:
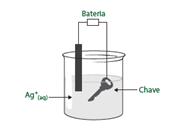
a) anodo, que é o pólo positivo.
b) anodo, que é o pólo negativo.
c) catodo, que é o pólo positivo.
d) catodo, que é o pólo negativo.
1º – Identificar o eletrodo onde ocorre a oxidação e onde ocorre a redução.
O objetivo do estudante do exercício é folhear sua chave com prata, ou seja, depositar prata metálica. A chave encontra-se em uma solução de íons Ag+, que ao reduzirem irão se tornar prata metálica, ou seja, a chave trata-se do eletrodo onde a redução ocorre.
Lembrando, no cátodo ocorre a redução (consoante-consoante) e no ânodo a oxidação (vogal-vogal). Logo, a chave corresponde ao cátodo, mas e quanto a carga?
Na eletrólise, ao contrário das pilhas e baterias, o cátodo é o eletrodo negativo e o ânodo é o eletrodo positivo, pois o fluxo de elétrons não é fornecido pela reação química, mas sim pela fonte de energia (bateria).
Resposta: d) cátodo, que é o pólo negativo.
Exercícios de identificação dos eletrodos e das espécies formadas na eletrólise em meio aquoso
03. (UNIFESP SP) A figura representa uma célula de eletrólise de soluções aquosas com eletrodo inerte. Também são fornecidos os potenciais padrão de redução (Eº) de algumas espécies.
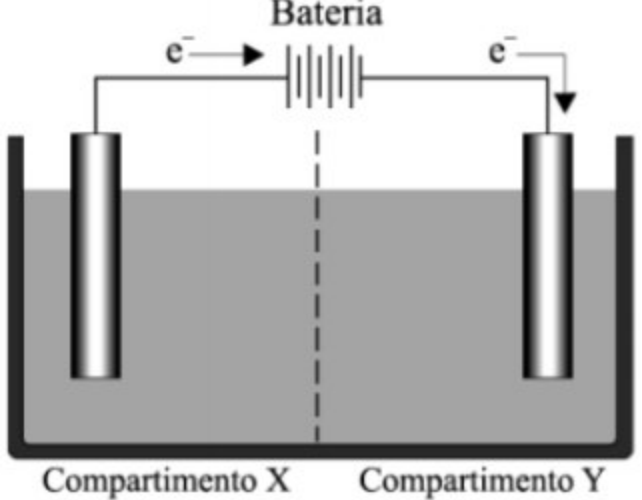
Na+ + 1e– → Na(s) Eº = – 2,71 V
2 H+ + 2e– → H2(g) Eº = 0,00 V
H2O(l) +1/2O2 + 2e– → 2 OH–(aq) Eº = + 0,40 V
Cl2(g) + 2e– → 2 Cl–(aq) Eº = + 1,36V
Para essa célula, foram feitas as seguintes afirmações:
I. O pólo positivo é o eletrodo do compartimento Y.
II. O ânodo é o eletrodo do compartimento X.
III. A ddp para a eletrólise de uma solução aquosa de NaCl(aq) é positiva.
IV. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás hidrogênio no eletrodo do compartimento Y.
V. Na eletrólise da solução aquosa de NaCl(aq) há formação de gás cloro no compartimento X.
São corretas somente as afirmações:
a) I, II, III e IV.
b) I, III e V.
c) I, IV e V.
d) II, III e IV.
e) II, IV e V.
Resolução:
Vamos analisar cada uma das afirmações:
I – O pólo positivo é o eletrodo do compartimento Y.
Como podemos observar na imagem, o eletrodo do compartimento Y está sendo carregado negativamente pelo fluxo de elétrons, portanto, INCORRETO.
II – O ânodo é o eletrodo do compartimento X.
O eletrodo do compartimento X está carregado positivamente, como podemos observar pelo fluxo de elétrons na imagem, lembrando que ao contrário das pilhas, na eletrólise o ânodo é o eletrodo carregado positivamente, portanto, CORRETO.
III. A ddp para a eletrólise de uma solução aquosa de NaCl(aq) é positiva.
Na eletrólise, o ddp é sempre negativo, pois trata-se de um processo eletroquímico não espontâneo que depende do fornecimento de energia elétrica. A quantidade de energia mínima necessária é a ddp. INCORRETO
IV. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás hidrogênio no eletrodo do compartimento Y
No compartimento Y, que é carregado negativamente e, portanto, trata-se do cátodo, é onde ocorre a redução. Na eletrólise aquosa do NaCl, temos duas espécies que podem sofrer redução, os íons H+ e os íons Na+. Como o potencial de redução do H+ (0,00 V) é muito maior do que o do Na+ (- 2,71 V), teremos formação do gás hidrogênio no compartimento Y. CORRETO
V. Na eletrólise da solução aquosa de NaCl(aq) há formação de gás cloro no compartimento X.
No compartimento X, que é carregado positivamente e, portanto, trata-se do ânodo, é onde ocorre a oxidação. Os íons Cl– descarregam elétrons no ânodo formando gás cloro. CORRETO
Resposta: e) I, IV, V.
E ai Gás Nobre, gostou das dicas? Preparado para ir bem nas questões de eletrólise?
Veja mais na playlist sobre Eletroquímica do nosso Canal!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


