Fala Gás Nobre, hoje vamos mostrar como resolver alguns exercícios sobre atomística, mais especificamente modelos atômicos. Atomística está sempre presente no ENEM e em diversos outros vestibulares, então bora ver como resolver alguns exercícios desse assunto pra ficar ninja. Reage!
Primeiramente, sugiro uma leitura sobre os modelos atômicos, pra dar aquela relembrada nas características de cada modelo e as diferenças entre eles.
Leia mais sobre em:
“O que você precisa saber sobre modelos atômicos” e
“Atomística: Entenda tudo sobre o estudo do átomo”
Gás Nobre fique ligado que darei dicas e relembraremos alguns conceitos de cada modelo durante as resoluções dos exercícios.
Preparado? Bora reagir.
Exercício 1
(FFFCMPA) De acordo com a teoria atômica de Dalton (1766-1844) assinale a alternativa correta
a) O átomo possui partículas de carga negativa que estão em órbita de um núcleo de carga positiva.
b) No núcleo atômico existem partículas de carga nula, denominada nêutrons.
c) Átomos de elementos diferentes possuíam diferentes massas e propriedades.
d) O átomo era uma esfera sólida que possuía partículas de carga negativa em sua superfície, semelhante a um “pudim de passas”.
e) Dois elétrons de mesmo spin não podem ser encontrados dentro de um mesmo orbital.
Resolução – Exercício 1
Gás Nobre, para responder essa questão temos que nos atentar que o modelo citado é o de Dalton, que trata-se do modelo “bola de bilhar”. Dalton acreditava que os átomos eram constituídos de uma partícula esférica indivisível e que elementos seriam constituídos de átomos com a mesma massa e propriedade e que essa massa e propriedades seriam diferentes para elementos diferentes.
Desta forma, Dalton não previa e não tinha conhecimento de nenhuma partícula subatômica, como nêutrons, prótons e elétrons. Logo, a única alternativa correta para este modelo é a alternativa C.
Gabarito:
c) Átomos de diferentes elementos possuíam diferentes massas e propriedades.
Leia mais em:
John Dalton
Modelo atômico de Dalton
Exercício 2
(ITA) Em 1803, John Dalton propôs um modelo de teoria atômica. Considere que sobre a base conceitual desse modelo sejam feitas as seguintes afirmações:
I. O átomo apresentará a configuração de uma esfera rígida.
II. Os átomos caracterizam os elementos químicos e somente os átomos de um mesmo elemento são idênticos em todos os aspectos.
III. As transformações químicas consistem de combinação, separação e/ou rearranjo de átomos.
IV. Compostos químicos são formados de átomos de dois ou mais elementos unidos em uma razão fixa.
Qual das opções abaixo se refere a todas as afirmações CORRETAS?
a) I e IV. b) II e III. c) II e IV. d) II, III e IV. e) I, II, III e IV.
Resolução – Exercício 2
Gás Nobre, apesar de não levar em conta as partículas subatômicas em seu modelo (não haviam sido descobertas ainda), Dalton foi capaz de prever e supor inúmeros processos envolvidos em uma reação química.
Como citado antes, seu modelo de átomo era constituído de uma partícula esférica e rígida e os elementos químicos seriam constituídos de átomos idênticos em todos os aspectos. Logo, as alternativas I e II estão corretas.
Com seu modelo, Dalton também previu que as transformações químicas ocorreriam através da combinação, separação e/ou rearranjo de átomos, enquanto os compostos químicos seriam formados de 2 ou mais elementos em proporções fixas. Logo, as alternativas III e IV também estão corretas.
Gabarito: e) I, II, III e IV.
Leia mais em: Leis Ponderais: Lavoisier, Proust e Dalton
Exercício 3
(UNESP) No ano de 1897, o cientista britânico J.J. Thomson descobriu, através de experiências com os raios catódicos, a primeira evidência experimental da estrutura interna dos átomos. O modelo atômico proposto por Thomson ficou conhecido como “pudim de passas”. Para esse modelo, pode-se afirmar que:
a) O núcleo atômico ocupa um volume mínimo no centro do átomo.
b) As cargas negativas estão distribuídas homogeneamente por todo o átomo.
c) Os elétrons estão distribuídos em órbitas fixas ao redor do núcleo.
d) Os átomos são esferas duras, do tipo de uma bola de bilhar.
e) Os elétrons estão espalhados aleatoriamente no espaço ao redor do núcleo.
Resolução – Exercício 3
O modelo proposto por Thomson avança em relação ao modelo de Dalton devido a descoberta de partículas de carga negativa menores que o átomo, os elétrons, deixando de lado o conceito de indivisibilidade proposto por Dalton.
Como os átomos possuíam carga neutra, Thomson criou o seu modelo acreditando que o átomo seria constituído por uma massa de carga positiva e estaria incrustado de partículas de carga negativa em sua superfície. Daí o nome ‘pudim de passas’.
As opções A, C, e E falam de núcleo, no entanto, o modelo de Thomson não prevê tal estrutura, logo, estão incorretas. Já a alternativa D cita o modelo de Dalton, portanto, também incorreta. Desta forma, a que melhor se aplica ao modelo é a alternativa B.
Gabarito: b) As cargas negativas distribuídas homogeneamente por todo o átomo.
Leia mais em: Modelo atômico de Thomson
Exercício 4
(UFPR) Considere as seguintes afirmativas sobre o modelo atômico de Rutherford:
1. O modelo atômico de Rutherford é também conhecido como modelo planetário do átomo.
2. No modelo atômico, considera-se que elétrons de cargas negativas circundam em órbitas ao redor de um núcleo de carga positiva.
3. Segundo Rutherford, a eletrosfera, local onde se encontram os elétrons, possui um diâmetro menor que o núcleo atômico.
4. Na proposição do seu modelo atômico, Rutherford se baseou num experimento em que uma lamínula de ouro foi bombardeada por partículas alfa.
Assinale a alternativa correta:
a) Somente a afirmativa 1 é verdadeira.
b) Somente as afirmativas 3 e 4 são verdadeiras.
c) Somente as afirmativas 1, 2 e 3 são verdadeiras.
d) Somente as afirmativas 1, 2 e 4 são verdadeiras.
e) As afirmativas 1, 2, 3 e 4 são verdadeiras.
Resolução – Exercício 4
Rutherford queria provar que o modelo de Thomson estava correto. Para isso, ele realizou um experimento onde bombardeava uma folha de ouro (de espessura muito fina) com radiação proveniente do núcleo radioativo do polônio. Acreditava que as cargas dos átomos estariam distribuídas uniformemente pela esfera e por isso, não existiriam regiões com concentração de carga negativa ou positiva.
Desta forma, esperava que as partículas alfas emitidas pelo polônio atravessassem a folha de ouro com nenhum (ou muito pequeno) desvio. Mas para seu espanto, um pequeno número de partículas alfa disparadas contra a lâmina de ouro começaram a sofrer desvios, provando assim a existência de uma região com densidade de cargas positivas e outra com negativas.
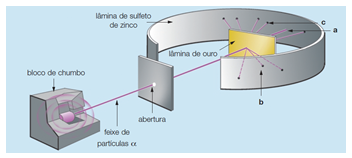
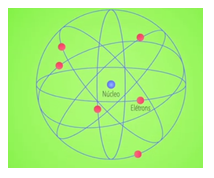
O modelo proposto por Rutherford passa a apresentar uma região de cargas positivas, chamada de núcleo e uma região com cargas negativas, chamada de eletrosfera, que apresenta uma área muito maior que a do núcleo. Rutherford também atribui ao seu modelo uma movimentação dos elétrons ao redor do núcleo na forma de orbitais, sendo assim apelidado de ‘modelo planetário’, por se assemelhar ao nosso sistema solar.
Dito isso, chegamos a conclusão de que as alternativas 1, 2 e 4 estão corretas. Exceto a 3, pois a eletrosfera constitui uma região muito maior do que o núcleo. Rutherford observou essa diferença de tamanho entre as regiões devido ao número de partículas desviadas. Uma vez que apenas um número muito pequeno de partículas sofrem desvio, significa que a região que causa o desvio (núcleo) é muito menor que o restante do átomo.
Gabarito: d) Somente as afirmativas 1, 2 e 4 são verdadeiras.
Leia mais em: Modelo atômico de Rutherford
Exercício 5
(UFU) O átomo é a menor partícula que identifica um elemento químico. Este possui duas partes, a saber: uma delas é o núcleo constituído por prótons e nêutrons e a outra é a região externa – a eletrosfera – por onde circulam os elétrons. Alguns experimentos permitiram a descoberta das características das partículas constituintes do átomo. Em relação a essas características, assinale a alternativa correta.
a) Prótons e elétrons possuem massas iguais e cargas elétricas de sinais opostos.
b) Entre as partículas atômicas, os elétrons têm maior massa e ocupam maior volume no átomo.
c) Entre as partículas atômicas, os prótons e nêutrons têm maior massa e ocupam maior volume no átomo.
d) Entre as partículas atômicas, os prótons e nêutrons têm mais massa, mas ocupam um volume muito pequeno em relação ao volume total do átomo.
Resolução – Exercício 5
Gás Nobre, vamos fazer algumas considerações sobre as regiões do átomo (núcleo e eletrosfera) e suas partículas subatômicas (elétrons, nêutrons, prótons).
Núcleo: Região central do átomo, formado por prótons e nêutrons, ocupa uma pequena área comparado a eletrosfera, apresenta uma densidade de cargas positivas e representa quase a massa do átomo em sua totalidade.
Eletrosfera: Região externa do átomo, formada por elétrons, logo apresenta uma densidade de cargas negativas, representa quase toda a região do átomo mas possui massa desprezível.
Elétrons: Partículas de carga negativa e massa desprezível, localizadas na eletrosfera.
Prótons: Partículas de carga positivas e massa 1824x maior que a do elétron, localizadas no núcleo.
Nêutrons: Partículas sem carga, ou seja, neutras, com massa igual ao próton, localizadas no núcleo.
Levando em conta essas considerações:
a) INCORRETA – Prótons possuem massa superior aos elétrons.
b) INCORRETA – Elétrons possuem a menor massa.
c) INCORRETA – Elétrons ocupam o maior espaço no átomo.
d) CORRETA.
Gabarito: d) Entre as partículas atômicas, os prótons e nêutrons têm mais massa, mas ocupam um volume muito pequeno em relação ao volume total do átomo.
Beleza Gás Nobre? Essa foi uma revisão desse conteúdo a partir da resolução de exercícios, espero que tenha gostado e ficado ninja pra mandar bem no ENEM nas questões de atomística. Reage!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


