Fala Gás Nobre, hoje vamos falar sobre uma teoria e seus conceitos, que nos ajudam a determinar a geometria molecular de várias substâncias químicas, a teoria RPECV (Repulsão dos Pares de Elétrons da Camada de Valência).
A teoria RPECV ou VSEPR, do inglês Valence Shell Electron Pair Repulsion foi formulada pelos químicos Ronald J. Gillespie (1924- ) e Ronald D. Nyholm (1917 – 1971) em 1957.
O professor Ronald Gillespie, aos 96 anos, é professor emérito da Universidade de McCaster (Canadá) e membro da Royal Society (Academia Real de Ciências da Inglaterra) e da Sociedade Real do Canadá (Academia Real de Ciências do Canadá).
A Teoria da Repulsão dos Pares de Elétrons da Camada de Valência (RPECV) é um modelo químico que busca deduzir a geometria molecular de um composto por meio da repulsão eletrostática dos elétrons na camada de valência.
Esta teoria parte da prerrogativa de que os pares de elétrons da última camada, ou seja, da camada de valência, se repelem. Tal repulsão faz com que estes pares de elétrons adotem conformações espaciais que minimizem essas repulsões, determinando, desta forma, sua geometria molecular.
Essa teoria determina com bastante precisão a geometria molecular de vários compostos químicos. No entanto, sofre críticas por limitar-se a prever a geometria apenas de moléculas covalentes.
Leia mais em:
Ligações Covalentes no nosso cotidiano: Parte I
Ligações Covalente no nosso cotidiano: Parte II
As etapas para determinar a geometria de uma molécula envolvem predizer o arranjo dos pares de elétrons ao redor de um átomo central, diferenciando os pares isolados (não ligantes) dos ligados a um ou mais átomos. A geometria observada no átomo central determina a geometria da molécula.
Leia mais em:
Aula: Geometria Molecular – Parte I
Estudo de Moléculas – Um resumo completo
Para determinarmos a geometria molecular, primeiramente devemos desenhar a estrutura de Lewis da molécula a ser analisada. Na estrutura de Lewis devem ser identificados os pares de elétrons ligantes e não-ligantes.
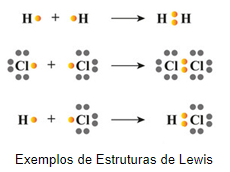
Conta-se então os pares de elétrons ao redor do átomo central, neste caso, quando temos ligações duplas ou triplas, contabilizamos apenas como 1 par de elétrons. Denomina-se número estérico a soma entre o número de pares de elétrons de átomos ligados ao átomo central e o número de pares de elétrons não-ligantes.
Considera-se que estes pares de elétrons estão localizados ao redor de uma esfera (átomo central) e que, em função da repulsão entre os pares, tendem a se orientar de forma a ficarem o mais distante possível um dos outros. Desta forma, o número estérico é que determina a geometria que a molécula irá possuir.
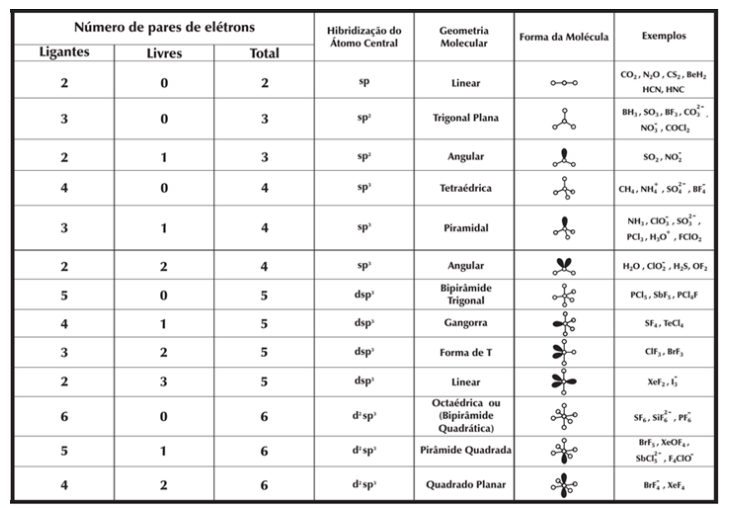
Por exemplo, quando temos 2 pares de elétrons, a repulsão faz com que eles fiquem em lados opostos, fazendo com que a molécula possua geometria linear. Já com 3 pares de elétrons, a máxima distância adotada pelos pares forma uma molécula de geometria trigonal plana. Enquanto 4 pares adota uma geometria tetraédrica.
A geometria ainda pode ser classificada distinguindo os pares de elétrons ligantes dos não-ligantes. Isso é possível pois elétrons ligantes envolvidos em uma ligação estão mais distantes do átomo central do que os pares de elétrons não ligantes. Isso faz com que a repulsão entre pares não-ligantes seja maior que entre pares ligantes, alterando levemente os ângulos de maneira a compensar a proporção destas repulsões.
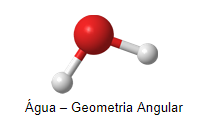
Isso pode ser observado na molécula de água, onde temos 4 pares de elétrons ao redor do oxigênio, 2 ligantes e 2 não-ligantes. A molécula de água possui geometria tetraédrica, se levarmos em conta todos os 4 pares, logo, espera-se um ângulo entre os pares de 109,5º, mas o observado é de 104,4º.
Em casos onde se tem um maior número de elétrons essa diferença de forças de repulsão é mais crítica, apresentando geometrias diferentes da esperada para aquele número de pares de elétrons.
A geometria é formada pela repulsão de todos os pares eletrônicos (ligantes e não-ligantes), no entanto, o nome que a geometria recebe é baseado apenas no pares de elétrons ligantes.
Por exemplo, como citado anteriormente, a água possui 4 pares de elétrons ligados ao oxigênio, o que atribui geometria tetraédrica, no entanto, apenas os pares ligantes são considerados na hora de nomear sua geometria, sendo então, angular.
Para determinar a geometria de uma molécula, seguimos os seguintes passos:
1 – Desenhar a estrutura de Lewis da molécula;
2 – Contar número de pares de elétrons ligantes e não-ligantes(livres) presentes na molécula (número estérico);
3 – Fazer a destruição dos pares de elétrons de forma a diminuir a repulsão ao máximo.
Seguindo estes passos, comparamos a geometria obtida com a tabela a seguir:
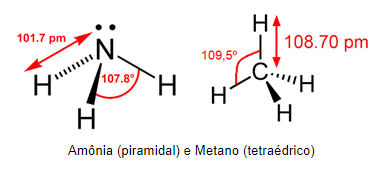
Um exemplo para ressaltar a diferença de repulsão entre os pares de elétrons ligantes e os não-ligantes é o caso da molécula do gás metano (CH4) e da amônia (NH3). Ambas possuem 4 pares de elétrons ligados ao átomo central, no entanto, o carbono (C) possui 4 pares ligantes, enquanto o nitrogênio (N) possui 3 ligantes e 1 não-ligante.
A maior força de repulsão do par não-ligante faz com que a amônia possua geometria piramidal, enquanto o metano apresenta geometria tetraédrica. Isso faz com que o ângulo entre os hidrogênios da amônia seja distinto do ângulo formado entre os hidrogênios do metano.
Esta teoria é utilizada geralmente para casos onde o átomo central está ligado a átomos de um mesmo elemento. No entanto, esta teoria permanece válida mesmo que o átomo central esteja ligado a átomos de elementos diferentes. Apenas observa-se pequenas variações nos ângulos previamente previstos para determinada geometria. O que torna esta teoria amplamente aceita e utilizada na determinação da geometria de inúmeras substâncias químicas.
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


