Em uma reação química cada substância apresenta uma quantidade de energia que é denominada entalpia, representado pela letra H.
Mas como determinar a entalpia?
Não é possível determinar a entalpia de cada substância. Na prática só é possível medir a variação da entalpia (ΔH) de uma reação, utilizando calorímetros. Essa variação corresponde a quantidade de energia liberada ou absorvida durante o processo e o cálculo da variação da entalpia é dado pela seguinte expressão:
∆H = Hfinal – Hinicial ou ∆H = Hprodutos – Hreagentes
Temos então que a variação está na diferença entre a entalpia dos produtos e a dos reagentes. Sendo assim, como fica a entalpia desses produtos e reagentes nas reações exotérmicas e endotérmicas?
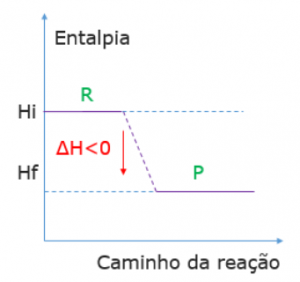
Reações exotérmicas
Ocorre a liberação de calor e, portanto, a entalpia dos produtos (HP) é menor do que a entalpia dos reagentes (HR):
Hprodutos < Hreagentes
R → P + calor ∆H = Hf – Hi (para descobrir qual a calor liberado)
HR > HP ∆H < 0
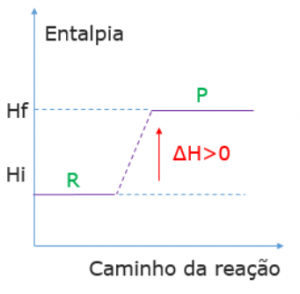
Reações endotérmicas
Ocorre absorção de calor e, portanto, a entalpia dos produtos (HP) é maior do que a entalpia dos reagentes (HR):
Hprodutos > Hreagentes
R + calor→ P ∆H = Hf – Hi (para descobrir qual a calor absorvido)
HR < HP ∆H > 0
A variação da entalpia de uma reação vai depender de alguns fatores como: temperatura, pressão, estado físico, número de mol e da variedade alotrópica das substâncias envolvidas. Por essa razão, foi criado um referencial para fazermos comparações, que é a entalpia padrão, representada por H0. Dessa forma, as entalpias são analisadas com a mesma condição (condição padrão ou estado padrão).
O estado padrão de uma substância corresponde a sua forma mais estável, a 1 atm, a 25°C.
Por convenção foi estabelecido que:
– As substâncias simples como: H2(g), O2(g), Fe(s), Hg(l), Cl2(g), no estado padrão e na sua forma alotrópica mais estável (mais comum) apresentam H0 = 0.
Devido a variação da entalpia depender desses fatores citados acima, como a pressão e a temperatura, na equação termoquímica é preciso indicar:
• a variação de entalpia (∆H);
• os estados físicos de todos os participantes, bem como, as variedades alotrópicas, caso existam;
• a temperatura e a pressão em que a reação ocorreu;
• o número de mol dos elementos participantes.
Veja essa equação, por exemplo:
1Cgraf + 1O2(g) → 1CO2(g) ΔH = –394 kJ a 25ºC e 1atm
Veja que a variação de entalpia é denominada entalpia ou calor de reação. Entretanto, alguns nomes são específicos para alguns tipos de reação, como: de formação, de combustão, de neutralização etc.
Química em Ação


