Gás Nobre, nesse artigo vamos falar de tudo o que você precisa saber sobre o pH, pOH, cálculos, escalas e interpretação, dando as melhores dicas para que você possa mandar bem nesse tema, seja para o ENEM, vestibulares, concursos, ou até mesmo, as provas escolares.
Então bora reagir?
pH e pOH
O pH (potencial hidrogeniônico) e o pOH (potencial hidroxiliônico) são escalas logarítmicas utilizadas para representar o caráter de uma solução diluída, ou seja, dizer se a solução é ácida, básica/alcalina ou neutra, ou até mesmo, responder perguntas como: o que seria mais ácido, uma solução contendo pH = 2,0 ou pH = 4,0?
Para compreendermos como o cálculo do pH e pOH pode ser realizado, é muito importante que tenhamos um domínio de alguns conteúdos básicos, como por exemplo, os tópicos abordados no estudo das funções inorgânicas, equilíbrio químico, e principalmente, o conteúdo de cálculo de concentração das soluções, pois é necessário que saibamos achar a concentração em quantidade de matéria (mol/L) de H+ (ou H3O+) ou OH–, no momento de resolver exercícios.
Se por acaso você achar pertinente rever esse conteúdo, eu recomendo essa aula minha:
Pois bem, uma vez achado a concentração em mol/L de H+ ou OH– em uma solução aquosa, como fazemos para achar o valor do pH (ou pOH)?
Como Calcular o pH de uma Solução?
Imagine que estamos resolvendo um exercício em que chegamos na concentração em mol/L de H+ (representamos assim [H+]) igual a 10-2 mol/L, como calculamos o pH?
Para responder essa pergunta, basta sabermos que pH = – log[H+]. Logo:
pH = – log[H+]
pH = – (-2)
pH = 2
Por analogia, se tivermos a concentração de [OH–], a fórmula para chegar no pOH seria pOH = -log[OH–].
Perceba que por mais que estejamos trabalhando com logaritmo, o cálculo é relativamente fácil.
Isso quer dizer se a concentração de H+ fosse 10-4, o pH seria 4?
Exatamente isso, Gás Nobre!
E se tivéssemos uma concentração de OH– equivalente a 10-4, qual seria o pH?
Como Relacionar pH e pOH?
Em uma situação onde temos a concentração de OH–, não podemos diretamente achar o valor do pH. A conversão de pOH para pH (ou vice-versa) é possível, e para isso precisamos saber que na temperatura de 25°C e 1 atm, temos que:
pH + pOH = 14
Então, na situação em que OH– é igual a 10-4, primeiro devemos achar o valor do pOH, que nesse caso será igual a 4, e depois jogamos na fórmula descrita logo acima, chegando em um valor de pH igual a 10. Simples, não é?
Mas não se esqueça que é necessário atenção, tudo bem? Por ser fácil essa conversão, muitos alunos acabam cometendo erros bobos com essa tarefa.
A Escala de pH e pOH
Para a visualização da característica de uma solução, temos a famosa escala de pH, que nos indica através dos valores, se uma solução é ácida, básica/alcalina ou neutra. Como não poderia faltar, também temos uma escala de pOH.
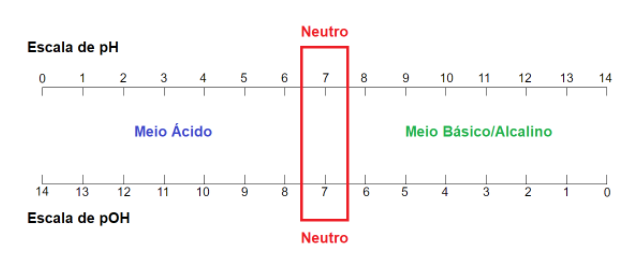
Como você pode reparar, da forma como as duas escalas estão demonstradas, fica fácil identificar que a solução com pOH igual a 4, apresentará pH = 10, e essa solução possui caráter básico/alcalino.
De forma contrária, uma solução com pH = 4, apresentará pOH = 10, e possui caráter ácido.
Um detalhe importante: quanto menor o valor do pH de uma solução, mais ácida esta será considerada, e de forma contrária, quanto maior o valor do pH, mais alcalina será considerada.
Isso quer dizer que uma solução com pH igual a 2, será considerada mais ácida do que uma solução com pH igual a 4, entendeu?
Quando o Cálculo do pH Fica Mais Complicado
Gás Nobre, há situações em que a aplicação do conceito de logaritmo acaba complicando muitos alunos, como por exemplo:
Uma solução apresenta [H+] = 8 x 10-5, dado log 2 = 0,3, qual o valor do pH?
Neste momento, não temos o pH igual a 5, como muitos poderiam dizer. Aqui, seria necessário aplicar os conhecimentos de logaritmo, identificando que 8 é igual a 2 x 2 x 2, ou 23, que de acordo com a propriedade dos logaritmos, teremos:
pH = – log[H+]
pH = – (0,3 + 0,3 + 0,3 – 5)
pH = – (0,9 – 5)
pH = – (- 4,1)
pH = 4,1
E aí, achou difícil? Conseguiu recordar esse conteúdo estudado em Matemática?
Independente da sua resposta, saiba que logo abaixo há uma aula minha sobre esse tema, que eu tenho certeza que você vai gostar bastante de assistir 😀
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


