Gás Nobre, você sabia que muitas reações acabam alcançando o que chamamos de “Equilíbrio Químico”?
Caso não saiba, fique aqui comigo, pois nesse artigo vou te contar o que é um equilíbrio químico, bem como, quando uma reação química atinge o estado de equilíbrio.
Bora reagir?
REAÇÕES REVERSÍVEIS E REAÇÕES IRREVERSÍVEIS
Existem processos em que não é possível “pegar” o produto formado, e transformar nos reagentes, ou seja, as substância que deram a sua origem. Vou demonstrar um exemplo. Observe a equação logo abaixo:
C(s) + O2(g) → CO2(g) + energia
A reação acima representa a combustão do carvão. Você por acaso já viu o carvão queimando (imagine um churrasco na sua casa), e algum processo fazendo com que depois de queimado, esse carvão voltasse ao normal?
Esse é um exemplo do que chamamos de “Reação Irreversível”, ou seja, uma vez formado os produtos, não é possível “reciclar” os reagentes.
Agora pense comigo: se existem reações IRREVERSÍVEIS, é porque existem reações REVERSÍVEIS, não é?
Pois é exatamente isso, Gás Nobre!
E um excelente exemplo, que diga-se de passagem, é bastante abordado em provas escolares, ENEM e vestibulares, vem ser a reação envolvida na síntese da amônia (NH3).
Observe a forma como vou representar esse processo:
N2(g) + 3 H2(g) ⇌ 2 NH3(g)
Por falar em síntese da amônia, tem um vídeo no meu canal contando a história de Fritz Haber, que eu acho que você vai gostar de assistir.
Percebeu que a reação acima utiliza do símbolo (⇌) para indicar que é um processo reversível?
Então vamos organizar o pensamento:
- ( → ) Indica que a reação é irreversível
- ( ⇌) Indica que a reação é reversível
Mas não é só isso, Gás Nobre. O que é muito importante lhe mostrar, é como uma reação reversível vai ser caracterizada “no mundo real”. Até então, estamos analisando apenas equações.
A VELOCIDADE DE UMA REAÇÃO
Algumas reações são rápidas, e outras, bastante lentas. A explosão de uma bomba, é uma reação rápida ou lenta? E a formação da ferrugem?
Percebe que a questão da velocidade é algo importante?
Ainda focando em uma reação irreversível, como seria o gráfico de desenvolvimento (de uma maneira geral e bem simples) levando em consideração a variação da quantidade dos participantes ao longo do tempo?
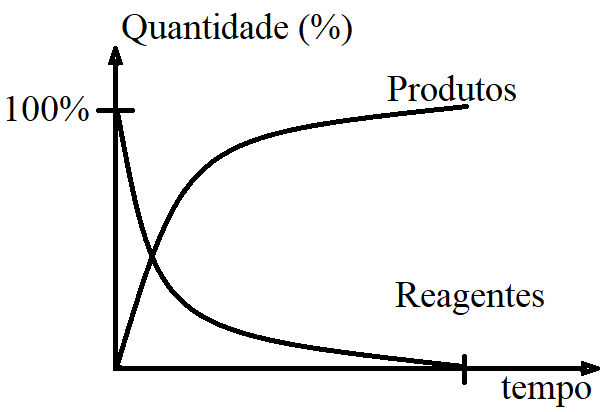
Gostaria que você observasse que, no início da reação tínhamos 100% dos reagentes e 0% dos produtos, e no final de tudo, os reagentes se esgotaram (chegaram a 0%) e os produtos foram totalmente formados (chegaram a 100%).
Essa é uma característica importante das reações irreversíveis: os reagentes se esgotam (considerando que a reação ocorreu com os reagentes em proporções estequiométricas), e os produtos são totalmente formados.
Por isso utilizamos o símbolo ( → ) para as reações irreversíveis.
E nas reações reversíveis?
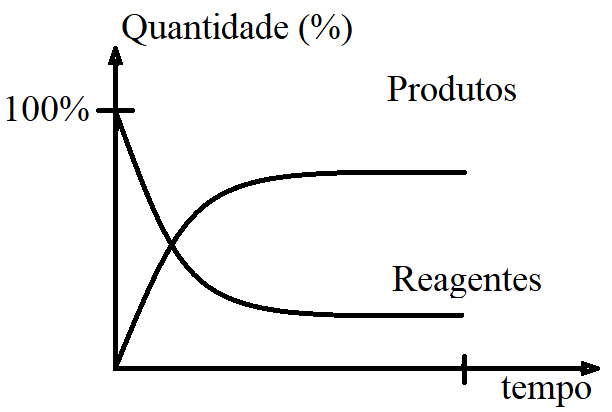
Mas uma vez, utilizando de um simples gráfico, eu gostaria que você observasse que nesse exemplo, nós não conseguimos esgotar os reagentes, e nem chegar a 100% dos produtos.
Em relação ao eixo Y do gráfico (onde temos as quantidades), há um determinado momento em que as quantidades (ou concentrações) não são alteradas. Veja a representação que fiz na cor vermelha:
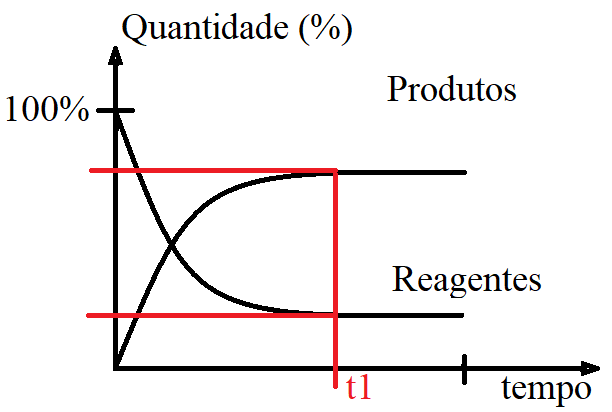
Já que em “t1” as quantidades não mudaram, então isso quer dizer que em “t1” a reação química parou?
E a resposta é: não!
Para explicar a razão de essa reação química não ter parado, preciso lhe fazer uma pergunta simples.
Faz de conta que você comprou uma esteira de corrida, e você seleciona a velocidade de 8 km/h. Qual a velocidade que você precisaria correr para não cair?
Os mesmos 8 km/h, não é?

E agora eu te faço uma outra pergunta: nessa situação da esteira, você está parado(a) ou está se movimentando?
A sua resposta deve ter sido: “estou me movimentando, mas não estou saindo do lugar, pois a velocidade que estou correndo (velocidade de ida) é igual a velocidade da esteira (velocidade de volta).”
Acertei?
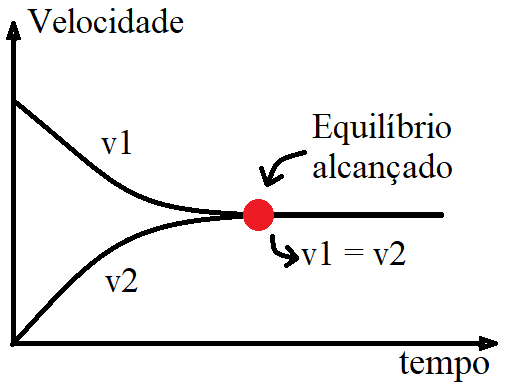
Pois é exatamente o mesmo que acontece com as reações reversíveis: em determinado momento, a velocidade de “ida” é igual a velocidade de “volta”.
Tecnicamente temos que:
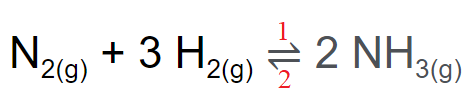
Sendo:
- “1” sentido da reação direta (reagentes formando os produtos)
- “2” sentido da reação inversa (produtos formando os reagentes)
E agora nós finalmente podemos responder a pergunta:
QUANDO UMA REAÇÃO QUÍMICA ATINGE O EQUILÍBRIO?
Gás Nobre, sempre que a velocidade da reação direta (v1) se iguala a velocidade da reação inversa (v2), temos o equilíbrio químico alcançado.
Equilíbrio Químico
v1 = v2
Gás Nobre, quer aprender mais sobre Equilíbrio Químico? Acesse:
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


