Fala Gás Nobre, hoje vamos falar das Leis Ponderais, também conhecidas como Leis das Reações Químicas ou ainda Leis das Combinações Químicas, que são diferentes leis determinadas experimentalmente por Lavoisier, Proust e Dalton.
Essas leis são empíricas, ou seja, surgiram a partir de observações feitas durante a realização de diversos experimentos e surgem no final do século XVIII e começo do século XIX.
Historicamente, estas leis surgiram antes mesmo das teorias atômicas modernas, ou seja, dos conceitos de átomos e moléculas, mas foram elas que ajudaram no surgimento destas ideias.
Leia mais em:
O que você precisa saber sobre modelos atômicos
Atomística: Entenda tudo sobre o estudo do átomo
As leis das reações químicas classificam-se em:
– Leis ponderais, que dizem respeito às massas
– Leis volumétricas, que dizem respeito aos volumes gasosos
As leis volumétricas foram estabelecidas por Louis Joseph Gay-Lussac (1778-1850), importante químico e físico francês, mas nesse post vamos apenas nos ater as leis ponderais, que trabalham apenas com relações envolvendo massa.
Leia mais em:
Estudo dos Gases
Teoria Cinética Molecular e o Estudo dos Gases
Vamos falar então de cada uma das 3 leis ponderais:
Leia mais em: Leis Ponderais
Lei da Conservação da Massa ou Lei de Lavoisier
Esta lei possui o seguinte enunciado “Numa reação química, a massa total dos reagentes é igual à massa total dos produtos dessa reação”. Isto é, a massa conserva-se, ou seja, a massa no final da reação sempre será a mesma que no início.
Lavoisier teve como inspiração para seus experimentos a célebre frase “na natureza nada se cria, nada se perde, tudo se perde” que pertence ao poeta grego Lucrécio (99a.C. – 55a.C.) que a escreveu no seu poema “Sobre a natureza das coisas”. Devido a formulação desta lei e sua importância científica, esta frase foi atribuída erroneamente a Lavoisier.
Antoine Laurent Lavoisier (1743-1794) foi um nobre francês que foi guilhotinado durante a revolução francesa. Em vida, Lavoisier realizou diversos estudos sobre reações de combustão, sobre as substâncias químicas até então conhecidas, por derrubar a teoria do flogístico e pela lei da conservação das massas.
É importante ressaltar que Lavoisier se tornou um dos maiores cientistas de sua época, sendo considerado o Pai da Química Moderna, em parte, graças à ajuda de sua esposa Marie-Anne, conhecida como Madame Lavoisier. Marie-Anne era além de cientista, ajudando diretamente nos experimento do marido, também tradutora, ilustradora e pintura, ajudando a difundir o conhecimento do marido para outros países.
Lavoisier estabeleceu a Lei da Conservação das massas ao observar experimentos envolvendo reações de combustão. Ele observou que na combustão de um metal a massa final do produto obtida era maior que a massa inicial e que na combustão de outros materiais, como o carvão, a massa do produto final era menor.
As reações químicas sempre até então sempre haviam sido feitas em sistemas abertos, até que Lavoisier teve a ideia de realizar essas reações em um sistema fechado. O sistema contendo os reagentes foi pesado no início e no término da reação, onde Lavoisier constatou que a massa total do sistema não havia sofrido alterações e que haviam então gases envolvidos nessas reações.
Lavoisier realizou diversas reações em sistemas fechados e pode comprovar que a massa total do sistema permanecia inalterada, estabelecendo assim a ‘Lei da Conservação das Massas’.
mreagentes = mprodutos
Lei das Proporções Constantes ou Definidas (Lei de Proust)
Esta lei foi estabelecida pelo químico francês Joseph Louis Proust (1755-1826) e possui o seguinte enunciado “A proporção em massa das substâncias que participam de uma reação e que são produzidas nesta é fixa, constante e não varia”. Ou seja, as massas de reagentes utilizados e de produtos formados terá sempre a mesma proporção.
Proust, através de experimentos, constatou que as massas das substâncias envolvidas numa reação são proporcionais. Isto é, que determinadas substâncias reagem com outras seguindo sempre a mesma proporção.
Mesmo que ocorra uma variação da massa, a proporção se mantém, por exemplo, consideremos a reação genérica: A + B --> C + D
Se 1g de A forma 2g de C, ao duplicamos a massa de A para 2g, vamos formar 4g de C e irá se observar essa proporção de 1A:2C para qualquer massa utilizada. Por isso o nome de Lei das Proporções Constantes.
A + B --> C + D
1g + 3g --> 2g + 2g
2g + 6g --> 4g + 4g
A Lei de Proust explica a proporcionalidade das massas envolvidas e serve como base para o balanceamento das reações químicas e os cálculos estequiométricos.
Leia mais em:
Aula: Introdução ao Cálculo Estequiométrico I
Aula: Introdução ao Cálculo Estequiométrico II
Aula: Cálculo Estequiométrico – Massa
Lei das Proporções Múltiplas ou Lei de Dalton
Esta Lei foi estabelecida por John Dalton (1766-1844), importante físico e químico inglês, conhecido, dentre outros importantes trabalhos, por seu modelo atômico de bola de bilhar, por ser o primeiro a descrever a doença que viria se tornar conhecida como daltonismo e pela Lei das Proporções Múltiplas que também leva o seu nome.
Leia mais em: John Dalton
A lei estabelece que “Quando dois elementos formam duas ou mais substâncias compostas diferentes, se a massa de um deles permanecer fixa a do outro irá variar em uma relação de número inteiros e pequenos”.
Através de diversos experimentos, Dalton observou que a massa fixa de um dos elementos da reação se combinava com diferentes massas de um segundo elemento formando diferentes compostos, mas que essas diferentes massas seguiam sempre uma proporção definida. Dai o nome “proporções múltiplas”.
Por exemplo, na reação do monóxido de carbono e do dióxido de carbono:
1 C + ½ O2 --> 1 CO
12g de C + 16g de O2 --> 28g de CO2
1 C + 1 O2 --> 1 CO2
12g de C + 32g de O2 --> 44g de CO2
Mantemos a massa de carbono fixa (12g) e variamos a massa de oxigênio em múltiplos de 16g, formando substâncias diferentes para cada massa de oxigênio utilizada.
O exemplo mais comum para esta Lei é a formação de diferentes óxidos de um mesmo elemento, por exemplo, os óxidos de nitrogênio:
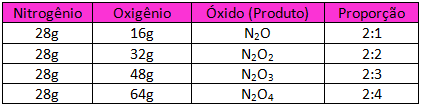
Podemos observar que ao mantermos a massa de nitrogênio fixa (28g) e reagirmos com diferentes massas de oxigênio (múltiplas de 16g) podemos obter diferentes produtos.
A Lei de Dalton, por abranger uma menor quantidade de compostos, encontra-se em desuso, sendo pouco abordada no ensino médio ou nos vestibulares de forma geral.
No entanto, as Leis de Lavoisier e Proust são amplamente utilizadas no cálculo estequiométrico e em cálculos de rendimento de reação, que estão sempre presentes no ENEM e demais vestibulares. Então fique ligado nas nossas redes sociais para sempre ficar por dentro destes conteúdos. Reage!
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda nesse ano.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


