Fala Gás Nobre, hoje vamos falar sobre atomística para que você entenda tudo sobre o estudo do átomo. Bora reagir?
A atomística é a área da Química dedicada ao estudo do átomo e suas características. Ela é responsável por definir a estrutura atômica, as semelhanças entre alguns átomos, o histórico e as diferenças entre os modelos atômicos propostos ao longo dos anos, a representação dos elementos químicos e as notações e nomenclatura envolvidas.
O átomo é a unidade básica que compõe todos os elementos químicos, inicialmente era considerado indivisível o que originou seu nome. Átomo vem do grego ‘a’ (negação) e ‘tomo’ (divisível), ou seja, ‘átomo’ significa “indivisível” “não divisível”.
Ao contrário do que muitos livros retratam, a primeira pessoa a pensar no conceito do átomo e a cunhar o termo não foi o químico inglês John Dalton, mas sim o filósofo grego Demócritos. (460 a.C – 370 a.C)
Demócritos tinha uma teoria de que tudo que existe é composto por elementos indivisíveis chamados de átomos.
Com o passar do tempo, partículas menores do que os átomos foram sendo descobertas, sendo chamadas de partículas subatômicas. No entanto, optou-se por manter a nomenclatura de “átomo”, devido ao seu tempo de uso.
Modelos atômicos foram propostos a cada nova partícula descoberta, sendo alguns dos mais conhecidos o de: Dalton, Thomson, Rutherford, Bohr, Schrödinger.
Estes 5 modelos estão representados na imagem abaixo:
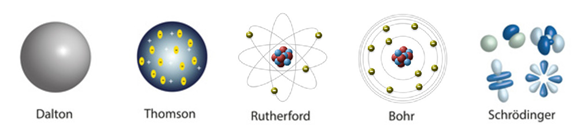
Estrutura do Átomo
O modelo atômico atual, o de Schrödinger, é bastante complexo e, portanto muito utilizado na física, química e mecânica quântica.
No entanto, o modelo de Bohr ainda é bastante aceito e consegue explicar muito bem a estrutura atômica e as partículas que compõem os átomos.
Este modelo divide o átomo em duas regiões, o núcleo e a eletrosfera. No núcleo é onde estão localizados os prótons (partículas de carga positiva) e os nêutrons (partículas sem carga), sendo também a região que concentra a maior parte da massa do átomo. Já a eletrosfera é onde estão os elétrons (partículas de carga negativa), que orbitam em camadas de diferentes quantidades de energia ao redor do núcleo.
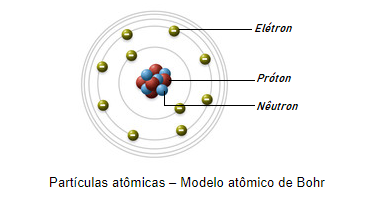
O conceito de eletrosfera surgiu em 1911, junto com o modelo atômico proposto por Rutherford. Ele que acreditava que os elétrons orbitavam o núcleo, de maneira semelhante aos planetas no sistema solar.
Bohr fez algumas alterações no modelo de Rutherford, organizando a eletrosfera em 7 níveis diferentes de energia. A eletrosfera passa a ser dividida em 7 órbitas que possuem energia fixa e que aumenta proporcionalmente com sua distância do núcleo.
Essas órbitas (níveis ou camadas) são representadas pelas letras K, L, M, N, O, P e Q, sendo K a mais próxima e, portanto, de menor energia e Q a mais afastada, e consequentemente, de maior energia.
Cada camada possui um número máximo de elétrons que pode comportar:
– Camada K: 2 elétrons;
– Camada L: 8 elétrons;
– Camada M: 18 elétrons;
– Camada N: 32 elétrons;
– Camada O: 32 elétrons;
– Camada P: 18 elétrons;
– Camada Q: 8 elétrons.
A relação entre o tamanho do núcleo e a eletrosfera é de em torno de 10 a 100mil vezes. Ou seja, apesar de possuir massa desprezível (por ser formada apenas por elétrons), a área eletrosfera é imensamente maior que a área ocupada pelo núcleo.
E devido a esta razão entre área ocupada e massa desprezível, pois a massa de um próton ou de um nêutron é 1800x maior que a de um elétron, concluiu-se que os átomos são formados, em sua maior parte, por espaços vazios.
Características do Átomo
– Número atômico (Z)
O número atômico indica o número de prótons que um átomo possui em seu núcleo, sendo a principal característica utilizada para a identificação e diferenciação de átomos entre si. Uma vez que cada átomo possui um número específico de prótons, ou seja, possuem número atómicos específicos.
– Massa atômica (A)
O número de massa de um átomo é dado pela soma do número de prótons e de nêutrons presente em seu núcleo. Podemos considerar que a massa de um átomo está concentrada em seu núcleo, pois a massa do elétron é quase que desprezível se comparada ao do próton e do nêutron.
A massa pode ser encontrada pela relação: A = Z + n (número de nêutrons).
Elemento Químico
Cada elemento químico é formado unicamente por átomos com o mesmo número atômico. Os elementos químicos são representados na tabela periódica, por 1 ou 2 letras, sendo sempre a primeira (ou a única, no caso de ser apenas 1) maiúscula.
Por exemplo: Fe – Ferro, C – Carbono, O – Oxigênio, Pt – Platina, etc…
Leia mais em: Conheça os elementos químicos que fazem parte do seu dia a dia
Representação Atômica
Os elementos químicos são representados em uma tabela chamada de tabela periódica. Nesta tabela estão representados todos os elementos que se tem conhecimento, sejam naturais ou sintéticos.
Os elementos são organizados em ordem crescente de número atômico (Z), que varia de 1 a 118. Como forma de padronização, devem estar representados na tabela: o símbolo, o nome, o número atômico (Z) e o número de massa (A) do elemento.
Os elementos também podem ser representados da forma ZXA, sendo o número atômico (Z) em subscrito e o número de massa (A) em sobrescrito.
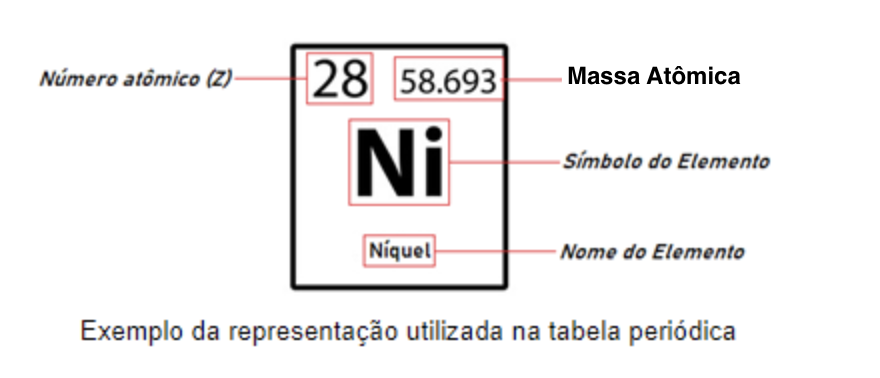
Exemplo da representação utilizada na tabela periódica
Leia mais em:
O que é a tabela periódica e como utilizá-la?
Os novos elementos da Tabela Periódica
Exercícios sobre Classificação dos Elementos na Tabela
Semelhança entre átomos
Átomos diferentes podem apresentar semelhanças, que podem ser no número de massa (isóbaros), quantidade de prótons (isótopos), nêutrons (isótonos) ou elétrons (isoeletrônicos).
– Isóbaros: São átomos que possuem a mesma massa, mesmo possuindo números atômicos diferentes, ou seja, número de prótons e nêutrons diferentes, mas mesma massa.
Por exemplo: 20Ca40 (20 prótons + 20 nêutrons) e 18Ar40 (18 prótons + 22 nêutrons).
– Isótopos: São átomos que possuem o mesmo número de prótons, mas que diferem no número de massa, ou seja, no número de nêutrons.
Por exemplo: 6C12, 6C13, 6C14, todos são isótopos do carbono (6 prótons), mas possuem 6, 7 e 8 nêutrons, respectivamente.
– Isótonos: São átomos que possuem o mesmo número de nêutrons, mas que diferem entre si no número de prótons (número atômico).
Por exemplo: 12Mg26 e 14Si28. Se utilizarmos a fórmula: A = Z + n, vamos observar que ambos possuem 14 nêutrons em seus núcleos.
– Isoeletrônicos: São espécies químicas (sejam átomos ou íons) que possuem o mesmo número de elétrons.
Por exemplo: 12(Mg2+)26 e 10Ne20. O magnésio possui 12 elétrons, no entanto, ao formar o íon Mg2+, perde 2 elétrons e passa a ter 10, mesmo número que o neônio possui.
Mas, como assim perder elétrons? Nós chamamos de íons os átomos que ganham ou perdem elétrons.
Íons
São poucos os elementos cujos átomos são encontrados na natureza no seu estado fundamental, isto é, neutros, com o mesmo número de prótons e elétrons. Alguns exemplos são os gases nobres (He – Hélio, Ne – Neônio, Xe – Xenônio, Ar – Argônio, etc..) e os metais nobres (Cu – Cobre, Ag – Prata, Au – Ouro, Pt – Platina, etc..).
No entanto, a grande maioria encontra-se ligado entre si (átomos do mesmo elemento) ou fazendo ligações com átomos de outros elementos.
Na busca por uma maior estabilidade alguns átomos perdem elétrons, ficando com um excesso de prótons, ou seja, um excesso de carga positiva, e que nós chamamos de cátions.
Já outros recebem/ganham elétrons, ficando consequentemente com um excesso de carga negativa, e que nós chamamos de ânions.
Esses íons são representados pelas cargas (número de elétrons que perdeu ou ganhou) juntas aos seus respectivos símbolos.
Por exemplo:
– Al3+: Carga 3+, pois perdeu 3 elétrons, ficando com excesso de carga positiva (cátion).
– O2-: Carga 2-, pois ganhou 2 elétrons, ficando com excesso de carga negativa (ânion).
Essa perda ou ganho de elétrons ocorre porque a maioria dos átomos possui um estado de menor energia quando se encontram na sua ionizada. Em resumo, podemos dizer que a natureza sempre busca o estado de menor energia.
O que podemos comprovar quando bate aquela preguiça e vontade de ficar mais 5 minutinhos na cama, não é mesmo?
Brincadeira a parte, Gás Nobre, espero que agora você já esteja fera sobre atomística. Reage!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


