Fala, Gás Nobre!Aqui no blog, já falei sobre o que é Cálculo de Concentração de Soluções, quais são os tipos e como você pode resolver cada um deles.
Por isso, neste post vamos colocar a mão na massa e resolver exercícios de alguns dos principais vestibulares do país.
E aí, preparado? Então simbora!
Cálculo de concentração de soluções: exercícios resolvidos
1. (UnB-DF) Em um rótulo de leite em pó integral, lê-se:
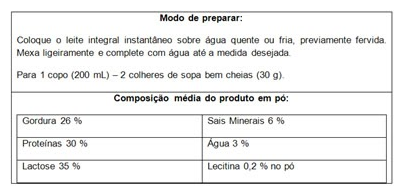
A porcentagem em massa indica-nos a quantidade de gramas de cada componente em 100 g de leite em pó. Calcule a concentração em massa (em g/L) de proteínas em um copo de 200 mL de leite preparado.
Resolução
Para começar, vamos calcular a concentração da solução feita a partir da mistura dos 30 g do leite em pó integral em 200 mL (1 copo) de água. Não se esqueça de que é necessário transformar o volume para L (200 mL → 0,2L):
C = m1 → C = 30 g → C = 150,0 g/L
V 0,2 L
Depois, fazemos uma simples regra de três, já que a proteína é igual a 30% da massa do leite:
100 % ———- 150,0 g/L
30% ———- x
X = 30 . 150/100
X = 45,0 g/L
Resposta: 45 g/L
2.(UFSCAR – SP) Soro fisiológico contém 0,900 gramas de NaCl, massa molar=58,5g/mol, em 100 mL de solução aquosa. A concentração do soro fisiológico, expressa em mol/L, é igual a:
a) 0,009
b) 0,015
c) 0,100
d) 0,154
e) 0,900
Resolução
Após analisar as informações dadas pela questão, você verá que precisará começar com a fórmula da concentração em quantidade de matéria (mol/L).
M = m / M1.V
M = 0,900 / 58,5 . 0,1
M = 0,154 mol/L
Resposta: Alternativa d) 0,154
3. (UFPI) Qual será o volume de água que deve ser acrescentado a 300ml de uma solução 1,5 mol/L de ácido clorídrico (HCl) para torná-la 0,3 mol/L?
a) 1000mL
b) 1500mL
c) 1200mL
d) 1800mL
e) 500 mL
Resolução
As informações disponíveis são:
Volume adicionado (Va)= ?
Volume inicial (Vi) = 300 mL
Molaridade inicial (Mi) = 1,5 mol/L
Molaridade final (MF) = 0,3 mol/L
Como não foi dado o volume final e o exercício pede o volume adicionado, temos que:
VF = Vi + Va
Logo:
VF = 300 + Va
Depois dessa operação, basta substituir o valor de VF na fórmula da diluição e molaridade:
Mi.Vi = MF.VF
1,5.300 = 0,3. (300.Va)
450 = 90 + 0,3.Va
450 – 90 = 0,3.Va
0,3.Va = 360
Va = 360/0,3
Va = 1200 mL
Resposta: Alternativa c) 1200mL
4. (UFRGS-RS) Um aditivo para radiadores de automóveis é composto de uma solução aquosa de etilenoglicol. Sabendo que em um frasco de 500 mL dessa solução existem cerca de 5 mols de etilenoglicol (C₂H₆O₂), a concentração comum dessa solução, em g/L, é:
As informações disponíveis são:
Massas molares (g/mol): H = 1,0; C = 12,0; O = 16,0
a) 0,010
b) 0,62
c) 3,1
d) 310
e) 620
Resolução
Em primeiro lugar, é necessário achar a quantidade de massa existente de soluto na solução. Assim, usamos a massa molar do etileno glicol, que é calculada da seguinte maneira:
C₂H₆O₂ = 2 . 12,0 + 6 . 1,0 + 2 . 16,0 = 62 g/mol
Depois, vamos para uma simples regra de três:
1 mol ——— 62 g
5 mol ——— m1
m1 = 310 g
Ao substituir os valores na fórmula da concentração comum, chegamos a:
V = 500 mL = 0,5 L
C = m1 / V → C = 310 g / 0,5 L → C = 620 g/L
Resposta: Alternativa e) 620
5. (Fuvest-SP) Considere duas latas do mesmo refrigerante, uma na versão “diet” e outra na versão comum. Ambas contêm o mesmo volume de líquido (300 mL) e têm a mesma massa quando vazias. A composição do refrigerante é a mesma em ambas, exceto por uma diferença: a versão comum contém certa quantidade de açúcar, enquanto a versão “diet” não contém açúcar (apenas massa desprezível de um adoçante artificial). Pesando-se duas latas fechadas do refrigerante, foram obtidos os seguintes resultados:
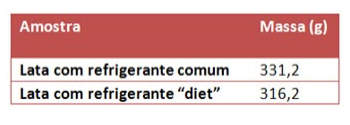
Por esses dados, pode-se concluir que a concentração, em g/L, de açúcar no refrigerante comum é de, aproximadamente:
a) 0,020
b) 0,050
c) 1,1
d) 20
e) 50
Resolução
Sabe-se que a diferença entre a massa do refrigerante comum e do diet é somente por causa do açúcar:
m(açúcar) = m(refrigerante comum) – m(refrigerante diet)
m(açúcar) = 331,2 – 316,2
m(açúcar) = 15 g
15 g de açúcar ——– 0,3 L de refrigerante (300 mL)
x ————————- 1 L de refrigerante
x = 1 . 15 / 0,3
x = 50 g de açúcar/L de refrigerante
Resposta: Alternativa e) 50
–
Gás Nobre, espero que esses exercícios tenham ajudado você a compreender melhor a resolução de cálculos de concentração de soluções. E se você quiser um auxílio no seu processo de estudo, venha estudar com a gente e realize seu sonho de cursar uma faculdade!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


