Fala Gás Nobre, tudo bem? Preparado para reagir? Nesse artigo vamos abordar o comportamento de um gás não ideal ou real. Mas antes de começarmos, você sabe qual é a diferença entre um gás ideal e real?
Revendo o Gás Ideal
Rever as características de um gás ideal, é um bom caminho para iniciarmos. Então que tal irmos direto ao ponto, e analisar duas características importantes de um gás ideal? Pois observe:
- O volume de um gás ideal pode se tornar nulo com o aumento da pressão.
- Não existe interação atrativa ou repulsiva entre as partículas de um gás ideal.
Normalmente, tais características não ocorrem com a maioria dos gases, devido às interações entre suas moléculas. Também não posso esquecer de mencionar a famosa equação de Clapeyron, que utilizamos para resolver problemas envolvendo um gás ideal. Você se lembra dela?

Mas vale ressaltar que, embora essa equação seja para os gases ideais, em algumas condições específicas, como alta temperatura e baixa pressão, a equação do gás ideal pode ser usada para os gases reais.
Características de um Gás Não Ideal
Das duas características mencionadas para um gás ideal, não sei se você percebeu que, sendo os gases formados por moléculas ou átomos (como os gases nobres), algum tipo de interação intermolecular devemos aguardar, e além disso, sendo os gases um dos estados físicos da matéria, e a definição de matéria vem ser tudo aquilo que ocupa lugar no espaço, sempre teremos algum volume ocupado, ainda que a pressão seja elevada.
Então basicamente nos gases não ideais, teremos:
- O seu volume não pode se tornar nulo com o aumento da pressão.
- Existe interação atrativa ou repulsiva entre as partículas.
E a Equação de Clapeyron, que utilizamos para resolver problemas com gases ideais, existe algo parecido para os gases não ideais?
A Equação de Van der Waals
O famoso PV = nRT possui aplicabilidade para os gases reais quando há baixa pressão (que reduz o número de moléculas por volume) e temperatura elevada (que aumenta a velocidade das moléculas), justamente pelo fato que nessas condições, a probabilidade das moléculas serem submetidas às forças atrativas é algo insignificante.
Em 1873, Van der Waals, formulou uma equação que leva em consideração tanto o espaço ocupado pelas moléculas, quanto as forças de atração intermoleculares:
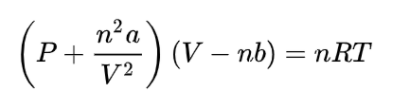
Sendo que nessa equação, o termo “a” significa uma constante relacionada com as forças de atração entre moléculas, e “b” significa o volume molecular. O valor dessas constantes varia conforme o tipo de gás calculado. Logo abaixo, seguem alguns exemplos:
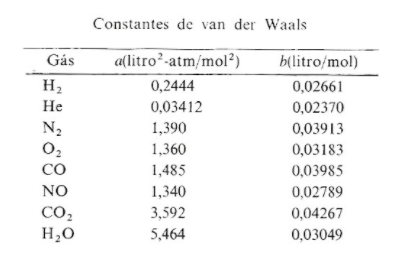
Gás Nobre, pensando em deixar a explicação s mais detalhada, resolvi colocar o trecho de um livro que utilizo no meu curso, que inclusive está à venda nesse link: https://conteudo.cienciaemacao.com.br/livro-didatico

“Um gás ideal é um gás hipotético, cujo volume pode tornar-se nulo pelo aumento da pressão. Na prática, isso não pode ser feito com um gás real devido à existência das moléculas, que têm volumes finitos. no gás ideal, também não existem interações atrativas ou repulsivas entre as partículas. No entanto, nos gases reais, as moléculas atraem-se devido às forças intermoleculares. Por isso, no caso dos gases reais, a Equação de Clapeyron deve ser corrigida, incorporando tais variáveis.” (Martino, A. Química: A Ciência Global, volume 1)
Então é isso, Gás Nobre 😀
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


