Fala Gás Nobre, você já ouviu falar nos Parâmetros e na Equação de Arrhenius? Hoje vamos estudar um pouco sobre essa Equação, seus Parâmetros e como utilizá-la para cálculos envolvendo o conteúdo de velocidade de reações.
Mas quem foi Arrhenius?
Svante August Arrhenius (1859 – 1927) foi um físico-químico sueco famoso por seus estudos envolvendo soluções eletrolíticas, onde desenvolveu a primeira teoria ácido-base e em cinética química, como veremos hoje.
Aqui no nosso blog nós já estudamos um pouco sobre quais são os fatores necessários para que uma reação química ocorra, segundo a Teoria das Colisões e já abordamos também os conceitos de Taxa de Reação e Leis de Velocidade.
Sabe-se que a velocidade de uma reação depende da energia e da frequência de colisões entre as moléculas que reagem, da temperatura e da orientação apropriada das moléculas ao colidirem. Estas condições resumem-se na equação de Arrhenius.
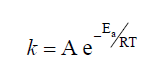
Onde,
k = Constante de velocidade da reação;
Ea = Energia de ativação da reação;
R = Constante dos gases (R = 8,314 J/K.mol);
T = É a temperatura em K (Graus Kelvin);
e = Base dos logaritmos neperianos ou naturais (e = 2,718…);
A = Frequência de colisões que acontecem com geometria correta.
O fator e -Ea/RT pode ser interpretado como a fração de moléculas que apresentam o mínimo da energia necessária para reagir. Seu valor é sempre menor do que 1, sendo 1 a representação de 100% das moléculas.
Verifica-se, por meio da Equação de Arrhenius:
– Se a energia de ativação (Ea) é elevada, a constante de velocidade é pequena, isto é, a reação é lenta;
– Para uma mesma reação, a constante de velocidade (k) aumenta com a temperatura.
Mas qual a aplicabilidade da Equação de Arrhenius?
Esta equação pode ser utilizada para duas finalidades em especial:
1. Calcular o valor da Energia de Ativação (Ea) a partir da dependência da constante de velocidade (k), em relação à temperatura (T);
2. Calcular a constante de velocidade (k), para determinada temperatura se a Energia de Ativação (Ea) e a A forem conhecidas.
Para realizarmos estes cálculos, podemos extrair dados de gráficos que correlacionam os valores da constante de velocidade (k) com a temperatura (T), como o exemplo abaixo:
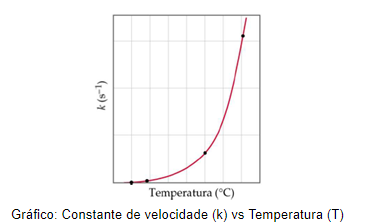
No entanto, precisamos linearizar este gráfico, para isso, precisaremos aplicar o logaritmo natural, ln, em ambos os lados da Equação de Arrhenius, obtendo a seguinte equação:
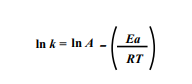
Rearranjando a equação acima, ela torna-se a equação de uma reta que relaciona k a (1/T), da seguinte forma:
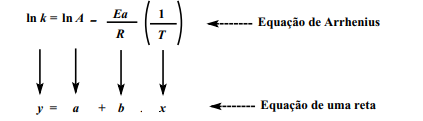
Desta forma, podemos calcular a Energia de Ativação (Ea) a partir dos valores experimentais da constante de velocidade (k) em diversas temperaturas. Ao desenhar o gráfico utilizando a equação descrita acima e os dados experimentais, obteríamos um gráfico como o abaixo:
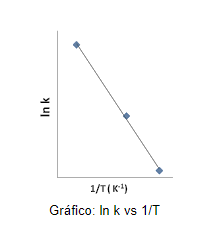
Todavia, além do método gráfico, também se pode determinar a energia de ativação (Ea) de forma matemática. Se conhecermos os valores de k para duas diferentes temperaturas, podemos escrever uma equação para cada uma delas:
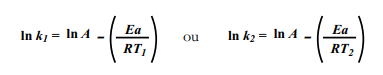
Se subtrairmos a equação de k1 na equação de k2, teremos:
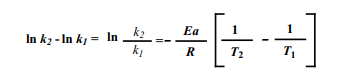
Resolvendo a equação, encontramos o valor da Energia de Ativação (Ea).
E aí Gás Nobre, que tal aplicarmos o que vimos até agora em um exemplo real?
Problema:
Considere a reação de decomposição do HI: 2 HI(g) → H2(g) + I2(g)
Calcule o valor da energia de ativação, Ea, usando os valores de k determinados em duas temperaturas diferentes.
k1= 2,15 x 10-8 L/(mol.s) em T1= 650 K
k2= 2,39 x 10-7 L/(mol.s) em T2= 700 K
Resolução:
Gás Nobre, como temos os valores de k1 , T1 , k2 e T2 , podemos usar a equação abaixo para calcular a Energia de ativação, Ea.
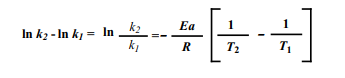
Substituindo os valores, teremos:
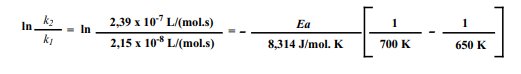
Calculando, teremos:
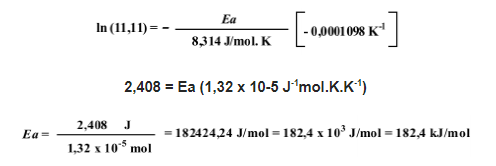
Assim, a Energia de ativação, Ea, é igual a: 182,4 kJ/mol
Ficou interessado neste assunto? Veja mais sobre assistindo nossa playlist no Youtube sobre Cinética Química.
Leia mais em:
Velocidade Média das Reações
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


