Fala Gás Nobre, hoje falaremos de forças intermoleculares, isto é, interações entre duas ou mais moléculas, dando ênfase as interações dipolo-dipolo: permanente e induzido.
O conceito de interações intermoleculares teve início há quase 150 anos atrás, quando o cientista holandês Johannes Diderik van der Waals (1837 – 1923), em 1873, determinou que existiam diferentes tipos de interações entre moléculas e que estas interações, por sua vez, apresentavam diferentes intensidades.
Van der Waals estabeleceu diferentes tipos de interação para diferentes moléculas com características em comum. Desta forma, van der Waals pôs fim num questionamento que já perdurava por muitos anos, sobre os diferentes pontos de fusão e ebulição que as substâncias apresentavam.
Leia mais em:
Forças Intermoleculares
Aula: Ligações Químicas – Forças intermoleculares
Van der Waals estabeleceu 3 tipos de forças intermoleculares, trabalho este que lhe concedeu o Prêmio Nobel de Física de 1910.
Posteriormente, estas forças intermoleculares vieram a ser conhecidas como “Forças de van der Waals” em sua homenagem, sendo elas:
1 – Ligações de Hidrogênio
2 – Dipolo-Dipolo permanente
3 – Dipolo-Dipolo induzido
Vamos então abordar neste texto as 2 últimas forças. Bora reagir?
Leia mais em:
Por que a lagartixa não cai quando anda pelas paredes?
Propriedades físicas dos compostos orgânicos
Dipolo – Dipolo permanente
Também chamada simplesmente de dipolo-dipolo, este tipo de interação acontece apenas entre moléculas polares. Ou seja, moléculas que não apresentam uniformidade de carga, possuindo uma região com maior densidade de carga negativa e uma com maior densidade de carga positiva.
Por exemplo, o ácido clorídrico (HCl), apresenta uma maior densidade de carga negativa no cloro, que é mais eletronegativo. Na imagem abaixo podemos observar essa diferença de densidade de cargas negativas representada na cor vermelha.
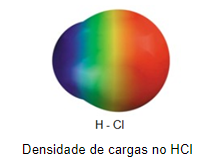
Essa maior densidade de carga faz com que ocorra a formação de um polo negativo e consequentemente, um positivo na molécula. A densidade de carga é representada pela letra delta minúscula (δ), acompanhada de um sinal positivo (δ+) para representar o polo positivo e a presença de uma maior densidade de cargas positivas, e de um sinal negativo (δ–), para representar o polo negativo e a maior concentração de cargas negativas.
Toda molécula polar apresenta esta diferença de densidade de cargas, formando sempre um dipolo elétrico, recebendo assim o nome de dipolo permanente.
Essas moléculas, ao entrarem em contato com outras moléculas vizinhas, acarretam na atração entre o polo positivo de uma com o polo negativo de outra e vice-versa.
Esta atração estabelecida entre as extremidades opostas dos dipolos das moléculas polares é chamada de força dipolo-dipolo permanente.
Podemos observar o arranjo realizado pela interação entre os dipolos destas moléculas na imagem a seguir:
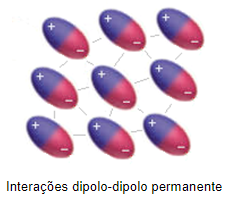
Isso tipo de interação é mais fraca que a do tipo ligações de hidrogênio, mas é mais forte que a do tipo dipolo-dipolo induzido, que veremos a seguir.
Dipolo – Dipolo induzido
Este tipo de interação intermolecular é também conhecido por: dipolo induzido – dipolo induzido, dipolo instantâneo – dipolo induzido e Forças de Dispersão de London.
A denominação de “Forças de Dispersão de London” é uma homenagem ao físico alemão Fritz Wolfgang London (1900-1954), que relacionou essa força intermolecular ao movimento de elétrons em uma molécula, podendo ser chamada apenas de Forças de London.
Ao contrário da interação do tipo dipolo-dipolo permanente que ocorre apenas entre moléculas polares, esta interação acontece apenas em moléculas apolares.
Moléculas apolares são moléculas onde há distribuição uniforme de cargas, ou seja, não há a formação de uma região com maior densidade de cargas negativas ou positivas.
Um exemplo de molécula apolar é a do gás cloro, formada por 2 átomos de cloro ligados entre si. Por não haver diferença de eletronegatividade entre eles a molécula não apresenta formação de dipolo elétrico ou regiões com densidades de cargas negativas ou positivas.
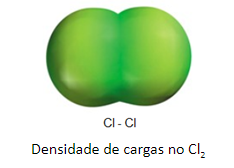
Essa interação pode acontecer de 2 formas, pela aproximação entre 2 moléculas apolares, que resulta numa repulsão dos elétrons, fazendo com que ocorra a formação de regiões com diferentes densidades de cargas, ou por um momento de assimetria de cargas no átomo. Como os elétrons estão livres na eletrosfera, eles possuem movimento e em dado momento, podem apresentar formação de um dipolo.
Esse movimento de elétrons foi previsto por London, lhe rendendo a homenagem deste tipo de atração receber seu nome. Como a formação deste dipolo acontece de maneira rápida e breve, chama-se de dipolo instantâneo.
Uma vez que este dipolo instantâneo é formado, sua parte com maior densidade de carga positiva irá ocasionar movimento de elétrons em moléculas apolares vizinhas, induzindo assim a formação de dipolos, por isso, a denominação dipolo induzido.
A imagem a seguir representa a formação do dipolo instantâneo seguido da indução da formação de pólos em outras moléculas vizinhas.
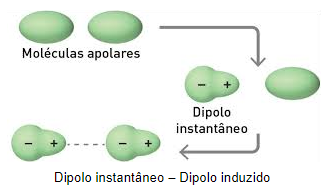
Por não possuir pólos permanentes, como nas moléculas polares, este tipo de interação é mais fraca.
As interações intermoleculares afetam propriedades como o ponto de fusão e ebulição, pois quanto maior a interação entre as moléculas, maior é a quantidade de energia necessária para realizar a mudança de estado físico.
Lembrando que no estado sólido as moléculas estão mais agregadas, diminuindo a sua interação ao passar para o estado líquido e tornando esta interação quase nula quando feita a mudança para o gasoso. Por isso, necessita-se de muita energia, na forma de calor, para realizar a mudança de estado físico de substâncias que possuem interações intermoleculares.
Leia mais em:
Aula: Introdução – Matéria e Estados Físicos
Mudanças de Estado Físico da Matéria
A fim de exemplificar a diferença de força entre as interações do tipo dipolo-dipolo permanente e dipolo-dipolo induzido, moléculas como o HF (polar), possui ponto de ebulição a 19,5ºC, enquanto moléculas como o H2 e F2 (apolares), possuem pontos de ebulição igual a -253ºC e -188ºC, respectivamente.
Ou seja, as interações do tipo dipolo-dipolo induzido são muito mais fracas do que as do tipo dipolo-dipolo permanente.
Portanto, saber identificar estes tipos de interações nos ajuda a prever os estados físicos e comportamento de alguns compostos, o que pode vir a ser útil no dia a dia e em provas de vestibulares.
Então Gás Nobre, pronto para arrasar nas questões envolvendo interações intermoleculares?
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


