Fala Gás Nobre, vamos falar hoje sobre a ligação iônica, que é uma dos 3 possíveis tipos de ligações que ocorrem entre 2 ou mais átomos.
Leia mais em: Aula: A Ligação Iônica
Ligação iônica é o nome dado a uma das três formas como os átomos podem interagir entre si. As outras formas de interação entre átomos são a ligação covalente, que ocorre entre átomos de ametais, hidrogênios, ou ametal e hidrogênio, e a ligação metálica, a qual acontece somente entre átomos de um mesmo metal.
A ligação iônica ocorre devido a transferência de elétrons da camada de valência de um átomo para a camada de valência de outro átomo. Sendo assim, na ligação iônica sempre teremos a formação de um cátion (carga positiva) e de um ânion (carga negativa), que são unidos por uma força, a força de atração eletrostática.
A ligação iônica ocorre entre íons!
Desta maneira, temos que a ligação iônica só pode ocorrer entre elementos que apresentam tendências opostas. Mas o que isso significa? Significa que um dos átomos participantes da ligação deve ter a tendência de perder elétrons enquanto o outro, deve ter a tendência de receber elétrons. Você sabe quais são esses elementos que possuem tendências opostas?
Metais: tendem a perder elétrons
Ametais: tendem a receber elétrons
Veja esse exemplo clássico: Formação do cloreto de sódio ou sal de cozinha.
Configuração eletrônica:
11Na: 1s22s22p63s1
17Cl: 1s22s22p63s23p5
Perceba que o átomo de sódio (Na) não é estável de acordo com a regra do octeto, pois apresenta apenas um elétron na camada de valência. Portanto, o átomo de sódio deve perder 1 elétron para atingir a estabilidade com oito elétrons na camada de valência e assim, formar o íon Na+. Enquanto que o cloro deve receber um elétron para se estabilizar, visto que, possui 7 elétrons na camada de valência e, assim, formar o ânion Cl–.
Desta maneira, a configuração dos íons formados será:
11Na+: 1s22s22p6
17Cl–: 1s22s22p63s23p6
Veja na representação de Lewis:
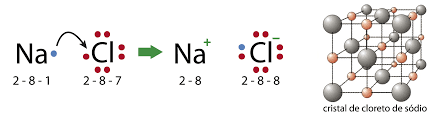
Os íons (Na+ e Cl–) que foram formados, possuem cargas elétricas opostas e por essa razão se unem através da força eletrostática, formando o composto NaCl.
Na+ + Cl– → NaCl
Esses compostos assim formados são denominados compostos iônicos e possuem estruturas eletricamente neutras.
Gás Nobre, de forma resumida, podemos dizer que a ligação iônica é uma interação entre átomos na qual sempre ocorre a perda e o ganho de elétrons, isto é, ela ocorre entre átomos que apresentam, obrigatoriamente, a natureza de ganhar ou perder elétrons.
Desta forma, a ligação iônica pode ocorrer entre:
– Um metal e um ametal;
– Um metal e o hidrogênio;
As fórmulas dos compostos formados a partir de ligação iônica sempre apresentam um padrão YX, em que o Y sempre será o elemento metálico. Dessa forma, para identificar um composto iônico, basta verificar se a fórmula inicia com um elemento metálico.
Características dos compostos químicos formados por ligação iônica
De uma forma geral, os compostos iônicos, isto é, substâncias formadas mediante ligação iônica, apresentam as seguintes características:
- São sólidos à temperatura ambiente;
- Seus átomos organizam-se de uma maneira a produzir um retículo cristalino (um cristal).
Obs.: Nos compostos iônicos, os átomos aglomeram-se de forma a ocupar os vértices de estruturas cristalinas. No cloreto de sódio, por exemplo, um ânion cloreto (esfera roxa) interage ao mesmo tempo com seis cátions sódio (esferas verdes):
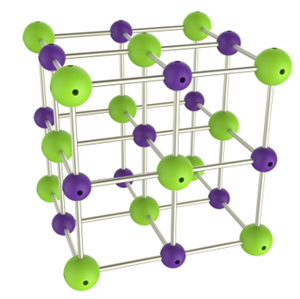
Representação da estrutura cristalina do cloreto de sódio
- São solúveis em água;
- São capazes de realizar o fenômeno da dissociação (liberação de íons) quando sofrem fusão, ou seja, quando passam do estado sólido para o estado líquido, ou quando estão dissolvidos em água;
- Apresentam elevados pontos de fusão e de ebulição;
- Possuem brilho;
- Conduzem corrente quando dissolvidos em água ou após sofrerem o processo de fusão.
Leia mais em: Compostos iônicos no nosso cotidiano
Gás Nobre, no nosso próximo post iremos ver como são determinadas as fórmulas dos compostos iônicos bem como o número de oxidação, isto é, a carga que os elementos químicos presentes nas principais substâncias que caem nas provas do ENEM e demais vestibulares para você ficar ninja nesse assunto.
Aproveite e assista a minha aula sobre a ligação iônica para ir revisando este conteúdo. Reage!
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda nesse ano.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


