Fala Gás Nobre, hoje falaremos sobre a massa atômica e a massa molecular, que são, respectivamente, a massa de 1 único átomo de um elemento ou de uma única molécula de algum composto, como por exemplo, a água.
Mas antes de falarmos de número de massa atômica e molecular, precisamos conceituar algumas coisas.
O conceito de átomo é muito antigo, sendo citado pela primeira vez por Demócrito, poeta grego que viveu entre 460a.C. e 370a.C., no entanto, uma concepção científica do mesmo foi dada apenas por John Dalton, físico e químico inglês, em um manuscrito datado de 6 de setembro de 1808.
Leia mais em:
John Dalton
Modelo atômico de Dalton
O conceito de átomo, vem do grego ‘a’-sem e ‘tomo’-divisão, ou seja, o átomo seria a menor parte da matéria, indivisível. Hoje em dia são conhecidas partículas menores que os átomos, chamadas de subatômicas, como os prótons, nêutrons e elétrons, no entanto, manteve-se a nomenclatura ‘átomo’ devido a sua importância histórica e ser amplamente utilizada no mundo inteiro.
Os átomos constituem a matéria e a matéria e suas transformações são o objeto de estudo dos químicos, ou seja, fazia-se necessário a padronização de uma unidade para definir a massa de um átomo.
Leia mais em:
O que você precisa saber sobre modelos atômicos
Atomística: Entenda tudo sobre o estudo do átomo
Foi escolhido então o isótopo de carbono 12 como padrão, que é o isótopo do carbono mais abundante, formado por 6 prótons e 6 nêutrons, ou seja, possui massa igual a 12. Dividiu-se em 12 fatias e a 1 destas fatias atribui-se o valor de 1u, ou seja, 1 unidade de massa atômica. A unidade de massa atômica é então representada por ‘1u’ e representa 1/12 da massa atômica do isótopo de carbono 12. Em gramas, atualmente sabe-se que 1u = 1,66054 x 1024g.
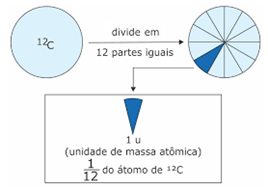
Na representação acima, temos um átomo de carbono, seguindo o modelo de esferas maciças de Dalton, sendo dividido em 12 fatias, onde cada uma representa 1u. A massa atômica dos elementos é dada então por quantas unidades de massa atômica o formam (quantas fatias), por exemplo, o flúor possui massa atômica igual a 19u, o carbono igual a 12u, o oxigênio igual a 16u, assim por diante.
No entanto, este valor é arredondado, uma vez que a massa de 1 próton e de 1 nêutron equivalem a 1,0073u e 1,0087u, respectivamente, logo, a massa do carbono 12 (6 prótons e 6 nêutrons) é igual a 12,096u.
De forma geral, a massa dos isótopos é dada apenas pela soma do número de prótons e nêutrons, por exemplo, o isótopo 26Fe possui 26 prótons e 30 nêutrons, logo, sua massa atômica é de 56u (26+30).
Gás Nobre, você já reparou que na Tabela Periódica, temos alguns elementos cuja massa não possui um valor inteiro, tipo o cobre (M = 63,5)? Se não existe meio próton ou meio nêutron, como podemos explicar isso?
Leia mais em:
O que é a tabela periódica e como usá-la
A história da tabela periódica
Isso acontece porque alguns elementos possuem mais de 1 isótopo, por exemplo, temos o isótopo 12 do carbono, que é o mais abundante, mas também temos os isótopos 13 e 14, com 7 e 8 prótons, respectivamente.
A massa atômica é dada pela média entre a soma dos produtos da massa do isótopo e sua abundância. Mas como que determinamos a abundância destes isótopos?
Esta determinação é realizada em laboratório através de um equipamento chamado espectrômetro de massa, que indica a massa de um isótopo com a precisão de até 6 casas decimais, dependendo do equipamento utilizado.
A partir da massa determinada de cada isótopo e a sua abundância, realiza-se o cálculo da média ponderada entre a abundância e massa de cada um, vide exemplo a seguir:
Neônio (Ne), este elemento possui 3 isótopos: 20Ne, 21Ne e 22Ne, que possuem abundância de 90,92%, 0,26% e 8,82%, respectivamente. Logo, para calcular a sua massa atômica (MA) média, temos que multiplicar a massa de cada um destes isótopos pela sua respectiva abundância e fazer a média.
MA = [(20 x 90,92) + (21 x 0,26) + (22 x 8,82)] / 100
MA = (1818,4 + 5,46 + 194,04) / 100
MA = 2017,9 / 100
MA = 20,179u
E é este valor que consta na tabela periódica. Para os demais elementos que apresentam mais de 1 isótopo, sua massa foi determinada pelo mesmo processo.
Agora que vimos o que é a massa atômica e como determina-la, falaremos sobre a massa molecular.
Já a massa molecular, é dada pela soma das massas atômicas dos átomos que constituem a molécula, por exemplo, a massa molecular da água é dada pela soma das massas atômicas dos 2 hidrogênio e do oxigênio que a formam. Sendo também representada por ‘u’ (unidade de massa atômica).
Massa molecular H2O = (2x massa atômica do hidrogênio) + massa atômica do oxigênio
Massa molecular H2O = (2x 1u) + 16u
Massa molecular H2O = 18u
Leia mais em:
Aula: Massa Atômica, Massa Molecular, Massa Molar e Mol
Como calcular a massa molar e a massa molecular
Gás Nobre, sabendo extrair os dados da massa atômica de cada elemento da Tabela Periódica e fórmula molecular do composto, podemos determinar sua massa molecular.
De forma geral, a massa atômica é a massa de 1 único átomo de um elemento e é dada pela média entre o produto da massa de cada isótopo e sua abundância. Já a massa molecular é dada pela soma das massas atômicas dos elementos que a constituí.
Gás Nobre, fique ligado aqui no blog para ter acesso a conteúdo exclusivo e a continuação desse texto, onde falarei sobre massa molecular e o número de mol. Reage!
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda nesse ano.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


