Fala Gás Nobre, hoje vamos falar sobre os principais modelos atômicos e o que você precisa saber sobre eles. Mas para isso, faremos uma viagem no tempo.
Durante muito tempo a humanidade buscou explicações para os fenômenos observados da e na natureza. Uma dessas explicações era a busca por entender do que a matéria era constituída.
Desta forma, não podemos deixar de fora a contribuição dos filósofos gregos Demócrito e Leucipo, que viveram no século V a.C.. Demócrito era discípulo de Leucipo e ambos tinham uma teoria de que se começasse a dividirmos a matéria em pequenos pedaços, cada vez menores, chegaria um determinado momento em que seria impossível realizar uma nova divisão. Essa partícula indivisível foi chamada de átomo, que do grego, ‘a’ = não, ‘tomo’= divisão, átomo = não divisível.
No entanto, a ideia do átomo permaneceu esquecida durante muito tempo, ressurgindo apenas com o Renascimento, no século XVI. Na Europa, nesse período, vários cientistas se empenharam e desenvolveram estudos, teorias e modelos para propor melhores explicações para o conceito de átomo levantado por Demócrito e Leucipo.
Esses estudos culminaram no surgimento de diversos modelos, onde novos modelos completavam os modelos propostos anteriormente a partir de novos experimentos ou descobertas que foram realizadas sobre o átomo.
Nesse artigo vamos realizar um breve Estudo da Evolução dos Modelos Atômicos. Onde falaremos sobre o que você precisa saber sobre os modelos atômicos mais estudados no Ensino Médio, sendo eles: Modelo de Dalton, Thomson, Rutherford e Bohr. E aí, bora reagir?
O Modelo Atômico de Dalton (Modelo Bola de Bilhar)
John Dalton (1766-1846) foi um físico e químico inglês que em 1803 criou a primeira teoria atômica moderna, baseando-se nos aspectos quantitativos das Leis Ponderais, que culminou no primeiro modelo atômico.
Dalton cunhou a Lei das Proporções Múltiplas a partir de observações experimentais, pois notou que em uma reação entre 2 elementos químicos, a massa fixa de um dos elementos da reação se combinava com diferentes massas de um segundo elemento formando diferentes compostos, mas que essas diferentes massas seguiam sempre uma proporção definida.
Leia mais em: Leis Ponderais: Lavoisier, Proust e Dalton
Diante essas observações, Dalton supôs que todo elemento químico era composto por partículas extremamente pequenas e indivisíveis. Resgatando assim o conceito proposto por Demócrito e Leucipo, chamando tais partículas de átomos.
O modelo de Dalton dizia que:
- Todo elemento é constituído por átomos;
- Os átomos de um mesmo elemento são todos idênticos; Átomos de elementos diferentes apresentam massa e propriedades diferentes;
- Os átomos não podem ser criados e nem destruídos;
- Os átomos se combinam em proporções fixas, em massa, para formarem compostos;
- Em uma reação química, não ocorre criação ou destruição de átomos, apenas combinação e rearranjo;
Dalton imaginava os átomos em forma de esferas maciças e indivisíveis, por isso, seu modelo ficou conhecido como o “modelo da bola de bilhar”.
Partindo do princípio de que átomos eram pequenas esferas indivisíveis, Dalton elaborou uma lista com modelos representacionais para diferentes elementos conhecidos na época.
Com este modelo representacional, passa então ser possível supor as estruturas de alguns compostos, por exemplo, o dióxido de carbono (CO2), chamado de ácido carbônico na época, era representado por uma esfera preta (Carbono) entre 2 esferas brancas (oxigênios). É importante lembrar que nessa época não se sabia da existência dos elétrons ou como uma ligação química era formada, então o que se tinham era apenas suposições de como essas moléculas eram formadas a partir da massa de cada elemento utilizado na sua reação de formação.

Leia mais em:
John Dalton
Modelo atômico de Dalton
O Modelo Atômico de Thomson (Modelo do Pudim de Passas)
Joseph John Thomson (1856-1940) foi um físico britânico creditado pela descoberta e identificação do elétron, a primeira partícula subatômica a ser descrita.
J.J. Thomson fez tal descoberta em 1897, enquanto realizava experimentos com raios catódicos. Ele observava que os raios eram sempre desviados para o polo positivo, ou seja, possuíam uma carga negativa, já que cargas opostas se atraem. Thomson repetiu o experimento utilizando diversos gases diferentes e o resultado era sempre o mesmo, fazendo-o concluir que se tratava de uma partícula que fazia parte de toda a matéria.
Thomson também observou que esta partícula possuía carga e foi o primeiro a determinar a relação entre a carga do elétron e sua massa (1,758805 x 1011 C/kg)
Com essas observações e a descoberta do elétron, Thomson propõe um novo modelo atômico, onde o átomo seria uma esfera maciça e positiva, com elétrons incrustados homogeneamente na sua estrutura, tornando-a neutra.
Ao se descobrir uma partícula subatômica, isto é, menor do que o átomo, provou-se que o átomo não era menor partícula existente e nem mais indivisível. No entanto, optou-se por manter essa nomenclatura devido a sua importância histórica e já estar amplamente aceita pela comunidade científica da época. Vale ressaltar aqui que entre o modelo de Dalton e o de Thomson temos um intervalo de 94 anos.
Em reconhecimento pela descoberta do elétron, Thomson foi laureado com o Nobel de Física de 1906.

Leia mais em: Modelo atômico de Thomson
O Modelo Atômico de Rutherford (Modelo do Átomo Planetário)
Ernest Rutherford (1871-1937) foi um físico e químico neozelandês naturalizado britânico, que se tornou conhecido como “Pai da Física Nuclear”.
Ainda no início da carreira como cientista, descobriu o conceito da meia-vida radioativa, provando que o decaimento radioativo de um elemento resultava em um outro elemento, além de distinguir e nomear as partículas radioativas alfa e beta. Em reconhecimento a seus estudos e descobertas, foi laureado com o Nobel de Química em 1908.
Leia mais em:
O que é radiação nuclear?
Radioatividade: Decaimento Cluster
No entanto, seu trabalho mais reconhecido só viria acontecer em 1911. Com o avanço nos seus estudos no campo da radioatividade e com a ajuda de 2 colaboradores, Hans Geiger e Ernest Marsden, em 1909 Rutherford realizou um experimento que consistia em bombardear uma fina folha de ouro com partículas alfa (emitidas pelo elemento radioativo Polônio).
O objetivo deste experimento era comprovar que o modelo de Thomson estava certo, isto é, esperava-se que a maioria das partículas atravessaria a lâmina sem sofrer desvios e as que sofressem, seriam desvios muito leves. No entanto, o experimento demonstrou que uma quantidade pequena, porém significativa de partículas sofreu grandes desvios, ou foram defletidas para trás, conforme a imagem abaixo:
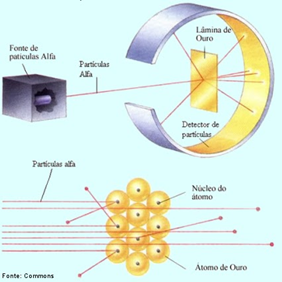
Esse resultado não podia ser explicado a partir do modelo atômico de Thomson, o que fez com que Rutherford repetisse o experimento e pensasse numa forma de explicar tal fenômeno durante 2 anos.
Em 1911, Rutherford propõe um novo modelo atômico, onde o átomo seria constituído por 2 regiões: núcleo e eletrosfera. O núcleo seria uma região muito pequena, que contém a maior parte da massa do átomo e teria carga negativa. Já a eletrosfera ocuparia a maior parte do átomo, sendo constituída principalmente por espaços vazios com elétrons girando ao redor do núcleo. Devido a semelhança com as órbitas realizadas pelos planetas ao redor do sol, seu modelo também é conhecido como “modelo do átomo planetário”.
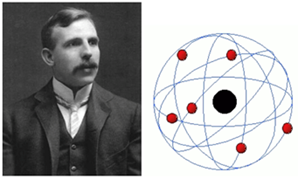
Rutherford ainda previu a existência de outra partícula subatômica, responsável por conferir carga positiva ao átomo. A descoberta dessa partícula foi realizada por ele mesmo em 1919, chamando-a de próton. No entanto, ele observou que a massa do núcleo era maior do que a massa dos prótons, fazendo-o prever a existência de outra partícula subatômica que estaria presente no núcleo, que deveria ter carga nula e massa idêntica a do próton.
Em 1932, essa partícula foi descoberta pelo físico britânico James Chadwick e foi denominada de nêutron.
Leia mais em: Modelo atômico de Rutherford
O Modelo Atômico de Bohr
Niels Henrik David Bohr (1885-1962) foi um físico dinamarquês cujos trabalhos contribuíram decisivamente para a compreensão da estrutura atômica e da física quântica. Bohr foi laureado com o Nobel de Física em 1922 em reconhecimento aos seus serviços na investigação da estrutura de átomos e da radiação emanada por eles.
Bohr acreditava que o modelo proposto por Rutherford apresentava um problema de acordo com a Física Clássica, pois os elétrons girando ao redor do núcleo em dado momento perderiam energia e acabariam colidindo com o núcleo.
Desta forma, utilizando-se do trabalho de Rutheford e de outros cientistas, como Max Planck e Albert Einstein, propôs um modelo atômico para o átomo de hidrogênio. Apresentados postulados para explicar a instabilidade do modelo de Rutherford, sendo eles:
– O elétron gira ao redor do núcleo em órbitas (níveis de energia) circulares de raios definidos, denominadas órbitas estacionárias.
– Cada órbita estacionária possui um valor determinado de energia. Nessas órbitas o elétron pode se mover sem perder ou ganhar energia.
– O elétron pode passar de uma órbita estacionária para outra, mediante absorção ou emissão de uma quantidade de energia. A quantidade de energia absorvida ou emitida, sempre na forma de fótons, é sempre igual à diferença de energia envolvida na transição (salto quântico ou eletrônico).
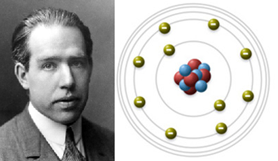
Desta forma, podemos interpretar o seguinte: O salto eletrônico para uma órbita de maior energia ocorre quando o elétron absorve fótons, e nessa situação dizemos que o elétron está em um estado excitado. Quando o elétron retorna para uma órbita de menor energia, há emissão de fótons (luz). Isso explicaria satisfatoriamente, por exemplo, os fogos de artifício e o teste da chama, onde a cor de cada elemento está relacionada a esses saltos quânticos.

Fonte: www.sciencenotes.org
Leia mais em: O que é a tabela periódica?
Pra finalizar, trago aqui a imagem dos 4 modelos atômicos aqui citados.
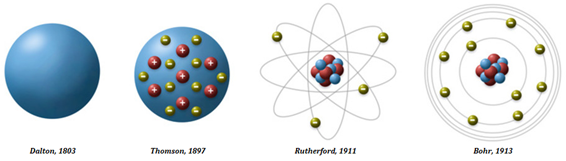
Gás Nobre, como podemos observar na imagem acima, mais de 100 anos separam o primeiro do último modelo citado, ou seja, vários experimentos foram realizados, vários outros cientistas realizam suas contribuições até chegarmos no modelo atual. Isso nos mostra que o conhecimento não uma mera descoberta, mas sim uma construção feita por várias pessoas ao longo da história, incrível não?
Beleza Gás Nobre, esse é um artigo bem completo com tudo o que você precisa saber sobre os modelos atômicos vistos no ensino médio, agora você tá pronto para detonar nas questões de atomística no ENEM.
E olha só, se quiser treinar seus conhecimentos sobre modelos atômicos, não deixe de olhar “Atomística – Modelos Atômicos: Exercícios Resolvidos”. Reage!
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda nesse ano.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


