Fala Gás Nobre, hoje falaremos sobre os números quânticos. Existem 4 números quânticos e juntos eles são o documento de identidade, a impressão digital de cada elétron presente na eletrosfera do átomo.
Os 4 números quânticos são: Principal, Secundário (ou Azimutal), Magnético e Spin. Estes número são utilizados como forma de identificação de cada elétron de um átomo, sendo assim, não existem 2 elétrons de um mesmo átomo com o mesmo conjunto de números quânticos.
Mas de onde surgiram esses números? Onde vivem? Como sabemos quem são? Hoje no Ciência em Ação Repórter. Brincadeiras a parte, vamos falar um pouco sobre a origem e o significado destes números.
Você já ouviu falar do Princípio da Incerteza de Heisenberg?
Werner Heisenberg (1901-1976) foi um físico teórico alemão que em 1927, aos 26 anos, demonstrou, usando os conceitos da mecânica quântica, que é impossível determinar, simultaneamente, com precisão, a velocidade e a posição de um elétron no átomo. Este princípio, conhecido também por Princípio da Incerteza, estabelece que não se pode afirmar que exista uma órbita definida para o elétron. Sendo assim, ele considerou que existem regiões, denominadas orbitais, em torno do núcleo que a probabilidade de encontrar o elétron é máxima.
“Orbitais são regiões do espaço com maior probabilidade de encontrar os elétrons”
Leia mais em:
O que você precisa saber sobre modelos atômicos
Atomística: Entenda tudo sobre o estudo do átomo
O movimento do elétron ao redor do núcleo foi descrito por Schrödinger, mediante uma equação matemática denominada equação de onda, que relaciona o comportamento de dualidade (onda-partícula), a energia, a carga e a massa do elétron.
As soluções numéricas para essa equação foram denominadas números quânticos e permitem que cada elétron seja caracterizado pela sua quantidade de energia.
Sendo assim, os números quânticos são como códigos matemáticos que estão associados a energia do elétron. A caracterização de cada elétron no átomo é feita pelos quatro números quânticos citados anteriormente: principal (n), secundário ou azimutal (l), magnético (m ou m1) e spin (s ou ms).
Lembrando que em um mesmo átomo não existem dois elétrons com os mesmos números quânticos. Temos aqui o Princípio de Exclusão de Pauli.
Os 4 Números Quânticos
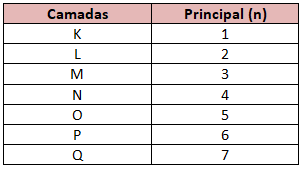
– Principal (n)
Cada nível de energia ou camada é um número quântico representado por “n”. Portanto, o principal indica o nível de energia ou camada eletrônica em que o elétron está.
– Secundário ou Azimutal (l)
Cada nível é composto por subníveis que são representados pelo número quântico secundário ou azimutal representado pela letra “l”. Mas como saber em qual número quântico secundário o elétron se encontra?
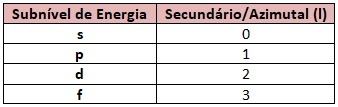
Por exemplo, se o elétron está no subnível “s”, significa que o seu número quântico secundário é zero (0), agora se estiver no subnível “f”, seu número quântico secundário será (3).
– Magnético (m)
Indica a região de máxima probabilidade de se encontrar o elétron, essa região é denominada orbital. Cada orbital, comporta no máximo 2 elétrons.
O orbital é representado geralmente por um quadrado. Para entender como determinar esse número quântico, vamos representar os elétrons nos orbitais.
Aqui temos a representação de um orbital. O elétrons são representados pela seta que é chamada de spin.

Ao preencher esses orbitais, deve-se seguir a Regra de Hund. Ela diz que os orbitais devem ser preenchidos com todas as setas para cima e só depois voltamos preenchendo com as setas para baixo. Cada subnível possui uma quantidade de orbitais, que estão de acordo com a quantidade de elétrons que cada subnível comporta. Logo temos que:
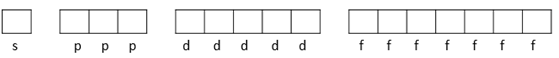
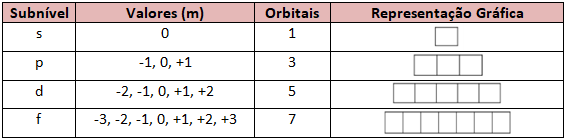
O subnível s só possui um orbital, isso significa que ele tem só uma forma em relação a sua orientação espacial, que é esférica.

Representação Gráfica:
m = 0
Já o subnível p possui três orientações espaciais, pois, conforme mostrado abaixo, ele é um duplo ovoide:
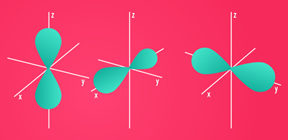
Representação gráfica:
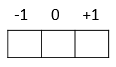
m = +1, 0 ou -1
O subnível d possui cinco orientações espaciais possíveis, sendo que o número magnético pode apresentar os seguintes valores:
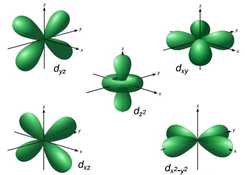
Representação gráfica:
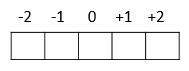
m = -2, -1, 0, +1, +2
Por fim, temos o subnível f que possui sete orientações espaciais possíveis:

Representação Gráfica:
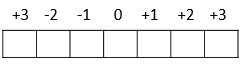
m = -3, -2, -1, 0, +1, +2, +3
Na tabela abaixo podemos conferir todos os possíveis números quânticos magnéticos:
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda nesse ano.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


