Fala Gás Nobre, hoje falaremos da Lei Volumétrica de Gay-Lussac, que assim como as Leis Ponderais é uma Lei sobre a proporcionalidade e quantidade de reagentes envolvidos em uma reação. No entanto, enquanto as leis ponderais são relações envolvendo a massa dos reagentes e produtos, a lei volumétrica refere-se aos volumes dos reagentes e produtos gasosos de uma reação.
As Leis Ponderais são aquelas que relacionam, de forma matemática, as massas dos reagentes e produtos de uma reação. Dentre as Leis Ponderais mais utilizadas temos a Lei de Conservação das Massas (ou Lei de Lavoisier), a Lei das Proporções Constantes (ou Lei de Proust) e a Lei das Proporções Múltiplas (ou Lei de Dalton).
Leia mais em:
Leis Ponderais: Lavoisier, Proust e Dalton
Já as Leis Volumétricas são aquelas que relacionam, de forma matemática, os volumes dos gases que participam de uma reação química. A mais importante e estudada destas leis é a que foi criada em 1808 pelo químico e físico francês Louis Joseph Gay-Lussac (1778-1850), chamada de Lei das Combinações de Volumes ou, da forma como é amplamente conhecida, de Lei Volumétrica de Gay-Lussac.
Depois de realizar inúmeros experimentos e medições dos volumes de gases envolvidos em uma reação química, Gay-Lussac concluiu que:
“Nas mesmas condições de temperatura e pressão, os volumes dos gases dos reagentes e produtos de uma reação química têm sempre entre si uma relação de números inteiros e pequenos.”
Números inteiros e pequenos? Como assim?
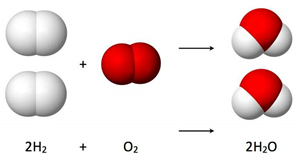
Vamos tomar como exemplo a reação de formação da água (H2O) a partir da reação entre gás hidrogênio (H2) e gás oxigênio (O2).
Ao observar esta reação, Gay-Lussac notou que nesta reação sempre ocorria o consumo de 2 volumes de hidrogênio e 1 de oxigênio na formação de 2 volumes de vapor de água. Observou também que esta proporção de 2 para 1 entre o hidrogênio e oxigênio se mantinha independente da quantidade de água formada, conforme tabela abaixo:

Note que para todos os volumes utilizados, a proporção de 2:1:2 é sempre respeitada, logo, dai surge o conceito de “números inteiros e pequenos”.
Gay-Lussac também observou que sempre havia uma relação entre os volumes das substâncias gasosas envolvidas numa reação, no entanto, a proporção variava de uma reação para outra.
Vamos ver mais 1 exemplo de reação com reagentes e produtos gasosos:

Note que para a reação de obtenção do ácido clorídrico esta proporção é de 1:1:2, mas que apesar de ser diferente da reação de formação da água, esta proporção não se altera, independente do volume dos reagentes utilizados.
Porém, na época, a teoria atômica aceita era a de Dalton, que dizia que a matéria era formada por partículas esféricas extremamente pequenas, maciças e indivisíveis, denominadas de átomos. De acordo com esta teoria, a quantidade de átomos deveria permanecer constante durante uma reação química, sendo o volume dos produtos deveria representar a soma dos volumes dos reagentes.
Para a reação da formação do ácido clorídrico isto era obedecido, pois temos a soma de 1 volume de gás hidrogênio (H2) com 1 volume de gás cloro (Cl2) formando 2 volumes de ácido clorídrico (HCl). No entanto, isso já não era observado na reação de formação na água, onde, de acordo com a proporção da reação, deveria ocorrer a soma de 2 volumes de gás hidrogênio (H2) com 1 volume de gás oxigênio (O2) formando 3 (2+1) volumes de água (H2O), mas experimentalmente são observados a formação de 2 volumes de água para cada 2 de hidrogênio e 1 de oxigênio.
Essa observação experimental de Gay-Lussac sobre a contração de volume que ocorria em algumas reações gasosas começou a por em dúvida a robustez da teoria atômica de Dalton.
Leia mais em:
John Dalton
Modelo atômico de Dalton
Anos depois, em 1811, o cientista italiano Amedeo Avogadro (1776-1856) explicou o porque tal contração de volume podia ser observada em algumas reações. De acordo com sua hipótese, que viria ser conhecida como Princípio de Avogrado anos depois, “volumes iguais, de quaisquer gases, nas mesmas condições de temperatura e pressão, apresentam a mesma quantidade de matéria, ou seja, o mesmo número de mols ou partículas”.
Infelizmente, Avogadro não chegou a conseguir determinado que número seria esse. No entanto, com o avanço da ciência, o número de mol pode ser determinado, com o valor de 6,02×1023 e foi chamado de “Constante de Avogadro” em sua homenagem, pois foi o primeiro a prever a sua existência.
De acordo com o Princípio de Avogadro, os gases não seriam formados por átomos isolados, mas sim por grupos de átomos, chamados moléculas. Desta forma, nas reações químicas, estes átomos presentes nas moléculas se recombinariam durante a reação química, podendo variar a quantidade de átomos recombinados, o que explicaria as proporções observadas.
Por exemplo, na reação de formação da água, temos 2 moléculas de gás hidrogênio, formadas por 2 átomos cada, reagindo com 1 molécula de gás oxigênio, formada por 2 átomos, formando 2 moléculas de água, formadas por 3 átomos cada. Como temos um produto formado por um maior número de átomos que os reagentes, têm-se a explicação do porque da contração do volume, que ocorre devido ao rearranjo dos átomos durante a reação.
De forma resumida, como citado anteriormente, a Lei Volumétrica de Gay-Lussac diz que, nas mesmas condições de temperatura e pressão, os volumes dos gases envolvidos em uma reação se mantêm em uma proporção fiz, de números inteiros e pequenos.
Gay-Lussac não parou apenas nos estudos envolvendo as proporções volumétricas dos gases, estudando também sobre a cinética (velocidade) das reações gasosas e as aplicações das leis da termodinâmica para estas reações.
Leia mais em:
Termodinâmica: Leis, Conceitos, Fórmulas e Exercícios
Teoria Cinética Molecular e o Estudo dos Gases
Exercícios sobre a teoria cinética dos gases
Infelizmente o Prêmio Nobel ainda não existia quando Gay-Lussac faleceu, pois provavelmente seria digno de possuir tal premiação. Mas, em reconhecimento a sua importância nos estudos nas áreas da Termodinâmica, Cinética Molecular, Gases, sendo autor de diversas leis, Louis Joseph Gay-Lussac é uma das 72 personalidades francesas que possuem o nome gravado na Torre Eiffel.
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda nesse ano.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.




