Fala Gás Nobre, hoje resolveremos algumas Questões sobre Concentrações de Soluções, veremos os diferentes tipos de questões sobre esse assunto e como resolvê-las. Preparado?
Mas primeiro, o que é a concentração de uma solução? O que é uma solução?
Soluções são misturas homogêneas onde o soluto (menor quantidade) encontra-se dissolvido em algum solvente (maior quantidade). Já a concentração das soluções corresponde a quantidade de soluto que encontra-se presente em uma determinada quantidade de solvente.
Leia mais em:
Introdução ao Estudo das Soluções
Soluções: Tudo o que você precisa saber
A concentração de uma solução pode ser expressa de diversas formas, dependendo da unidade escolhida, no entanto, ela sempre corresponderá a uma relação entre a quantidade de soluto e solvente de uma solução.
Existem várias formas de representar e calcular a concentração de uma solução, por isso, antes de partir para os exercícios falaremos brevemente sobre cada uma delas.
Concentração Comum (C)
A concentração comum é a relação estabelecida entre a quantidade de soluto em gramas (g) e o volume da solução em litros (L). Sendo expressa pela seguinte fórmula:
C = m/V
Onde,
C = concentração comum(g/L);
m = massa(g);
V = volume(L).
Importante ressaltar que concentração comum é diferente da densidade, ambas relacionam massa e volume, no entanto, enquanto na concentração comum usa-se a massa do soluto na densidade usa-se a massa da solução, outra diferença é que o volume utilizado no cálculo da densidade é dado em mililitros (mL), como podemos observar na equação abaixo:
d = m/V
Onde,
d = densidade (g/mL);
m = massa da solução(g) (massa do soluto + massa do solvente);
V = volume da solução (mL).
Leia mais em: Densidade
Concentração Molar ou Molaridade (M)
A concentração molar ou molaridade é a relação existente entre a quantidade de soluto em número de mols (mol) e o volume da solução em litros (L). A concentração molar é expressa através das fórmulas a seguir:
M = n / V
ou
M = m / MM.V
Onde,
M = Concentração molar (mol/L);
n = número de mols (mol);
m = massa do soluto (g);
MM = Massa molar do soluto (g/mol);
V = Volume da solução (L).
Leia mais em:
Número de Mol e Massa Molar
Mol e Massa Molar: Aprenda os conceitos
Título (τ)
O título ou porcentagem em massa da solução consiste na relação entre a massa do soluto e a massa da solução. Ele é dado a partir da seguinte fórmula:
τ = m1 / m
ou
τ = m1 / (m1 + m2)
Onde,
τ = Título;
m = massa da solução (g);
m1 = massa do soluto (g);
m2 = massa da solução (g);
O título não possui uma unidade de medida, sendo expresso, na maioria dos casos, em porcentagem. No entanto, para isso, deve-se multiplicar por 100 o valor do título:
% = 100 . τ
Quando temos uma solução gasosa ou líquida, o título também pode ser calculado a partir do volume da solução, substituindo os valores de massa por volume, a partir da fórmula a seguir:
τ = V1 / V
Onde,
V1 = Volume do soluto;
V = Volume da solução.
Porcentagem
O cálculo da porcentagem é dado pela razão entre quantidade de soluto por quantidade de solução multiplicado por 100. Essa porcentagem pode ser em razão de massa de soluto e massa de solução (m/m), volume de soluto e de solução (v/v) ou ainda massa de soluto e volume de solução (m/v). O cálculo pode ser feito com as fórmulas a seguir:
%(m/m) = (m1 / m) x 100
%(v/v) = (V1 / V) x 100
%(m/v) = (m1 / V) x 100
Onde,
m1 = massa do soluto (g);
m = massa da solução (g);
V1 = volume do solução;
V = volume da solução.
Partes por Milhão (ppm) e Partes por Bilhão (ppb)
Existem soluções onde o soluto encontra-se em concentrações extremamente pequenas, geralmente relacionadas a questões de química forense e química ambiental onde trabalha-se com substâncias com elevada toxicidade mesmo em concentrações muito pequenas.
Nestes casos trabalhamos com as concentrações chamadas “partes por milhão” e “partes por bilhão”, onde calculamos a quantidade de soluto em gramas (g) presente em 1 milhão de gramas (1 000 000g) ou 1 bilhão de gramas (1 000 000 000g) de solução.
1 ppm = 1 parte de solução / 106 partes de solução
1 ppb = 1 parte de solução / 109 partes de solução
Relação entre as Concentrações
Além das formas de se calcular a concentração de uma solução ainda podemos calcular a concentração de uma solução a partir das relações existentes entre a concentração comum, a densidade e o título. Para tanto, a seguinte fórmula é utilizada:
C = 1000 . d . τ
Onde,
C = Concentração Comum (g/L);
d = Densidade (g/mL);
τ = Título.
Podemos calcular a concentração molar a partir de uma relação muito semelhante, onde a fórmula utilizada é a seguir:
M = 1000 . d . τ / MM
Onde,
M = Concentração Molar (mol/L);
MM = Massa molar do soluto (g/mol);
d = Densidade (g/mL);
τ = Título.
Diluição de Soluções
Podemos calcular a concentração final de uma solução diluída a partir das seguintes fórmulas:
C1 . V1 = C2 . V2
ou
M1 . V1 = M2 . V2
Onde,
C1 = Concentração Comum inicial;
C2 = Concentração Comum final;
V1 = Volume inicial;
V2 = Volume final;
M1 = Concentração Molar inicial;
M2 = Concentração Molar final;
Leia mais em: Mapa Mental sobre Concentrações de Soluções
Beleza Gás Nobre? Agora com esse super resumo já estamos mais do que preparados para encarar e resolver algumas questões sobre concentrações de soluções. Bora?
01 – (UEM) O ácido fosfórico é um aditivo químico muito utilizado em alimentos. O limite de ingestão diária aceitável (IDA) em alimentos é de 5mg.kg-1 de peso corporal. Calcule o volume, em mililitros (mL), de um refrigerante hipotético que contém ácido fosfórico na concentração de 2g.L-1 que uma pessoa de 50kg poderá ingerir para atingir o nível máximo de IDA.
Resolução
Gás Nobre, para calcular a quantidade de refrigerante que esta pessoa pode ingerir primeiro temos que calcular a quantidade (massa) de ácido fosfórico que a mesma pode ingerir a partir do seu peso.
Temos que o limite é 5mg/kg e que a pessoa pesa 50kg, ou seja:
mácido fosfórico = 5mg/kg x 50kg
mácido fosfórico = 250mg
Temos que a concentração de ácido fosfórico no refrigerante é de 2g/L, ou seja, temos:
2g (2000mg) a cada 1L (1000mL), logo:
2000mg – 1000mL
250mg – x
x = 125mL
Isto é, esta pessoa atingirá o nível máximo de IDA ao beber 125mL deste refrigerante.
Gabarito: 125mL
02 – (FUVEST-SP) Solução de ácido clorídrico, de densidade 1,20kg/L, contém 40,0%, em massa, de HCl.
a) Qual é a massa de água, em gramas, existente em 1,00L de solução do ácido, nessa concentração?
b) Sabendo que o mol de HCl corresponde a 36,5g, calcule, com apenas dois algarismos significativos, a concentração molar da solução.
Resolução
Gás Nobre, temos que nos atentar ao que o exercício nos fornece de dados para saber qual fórmula utilizar nos cálculos. Se observamos temos a densidade (1,20kg/L), o título em percentual (40%) e na letra (a) o volume (1,0L).
Podemos obter a massa da solução pela fórmula da densidade:
d = m/V
1,20kg/L = m / 1,00L
m = 1,20kg (1200g)
Temos que a massa de ácido representa 40% da solução, ou seja:
(mácido / msolução) x 100 = 40
(mácido / 1200g) x 100 = 40
mácido / 1200 = 0,4
mácido = 480g
Obtemos a massa de água pela diferença entre a massa da solução e a massa de ácido:
mágua = msolução – mácido
mágua = 1200g – 480g
mágua = 720g
A letra (b) nos fornece a massa molar do ácido clorídrico (MM = 36,5g/mol) e nos pede a concentração molar desta solução. Podemos obter esta concentração utilizando a seguinte fórmula:
M = m / MM.V
M = 480g / (36,5g/mol x 1,00L)
M = 13,15mol/L
Gabarito:
a) 720g do solvente, 480g do soluto
b) 13,15mol/L
Leia mais em:
Concentração das Soluções
Cálculo de Concentrações de Soluções
03 – (UNESP) O teor de oxigênio dissolvido na água é um parâmetro importante na determinação das propriedades químicas e biológicas da água. Para se determinar a concentração de oxigênio, pode-se utilizar pequenas porções de palha de aço. Colocando uma porção de palha de aço em contato com 1 litro de água, por 5 dias em um recipiente fechado, observou-se que a massa de ferrugem (óxido de ferro III) formada foi de 32mg. Escreva a equação química para a reação de oxidação do ferro metálico e determine a concentração, em g.L–¹, de O2 na água analisada.
Massas molares, em g.mol–¹: Fe = 56 e O = 16.
Resolução
Gás Nobre, em questões envolvendo reações químicas o primeiro passo é escrever a equação da reação química em questão e certificar-se de que a mesma esta devidamente balanceada. Neste caso, temos a reação do ferro (Fe) da presente na palha de aço com o oxigênio (O2) dissolvido na água formando o óxido de ferro III (Fe2O3).
4 Fe(s) + 3 O2(g) 🡪 2 Fe2O3(s)
Precisamos também conhecer as massas molares das substâncias envolvidas no processo citado no enunciado:
MMFe = 56g/mol
MMO2 = 32g/mol
MMFe2O3 = 160g/mol
Sabemos que a proporção entre o oxigênio dissolvido (O2) e o óxido de ferro III é de 3 para 2 e que foram formadas no processo 32mg do óxido deste metal, logo:
3 mols de O2 – 2 mols de Fe2O3
3 x 32g – 2 x 160g
x – 32mg
x = 9,6mg de O2 (0,096g)
Logo, a concentração de oxigênio dissolvido é de 0,096g/L.
Gabarito: [O2] = 0,096g/L
04 – (UCS) Os alvejantes sem cloro podem ser utilizados tanto em roupas brancas quanto nas de cor, sem descolori-las, pois não contêm hipoclorito de sódio em sua composição. O princípio ativo desse tipo de alvejante é o peróxido de hidrogênio, na concentração de 5% (v/v). Supondo-se que uma dona de casa tenha utilizado 200mL desse alvejante em uma máquina de lavar contendo 5L de água, a quantidade de peróxido de hidrogênio adicionado às roupas será de
a) 2mL b) 5mL c) 10mL d) 25mL e) 50mL
Resolução
Gás Nobre, temos aqui um problema envolvendo concentração em título (porcentagem).
Temos que calcular quanto de peróxido de hidrogênio temos nos 200mL do alvejante e para isso, podemos utilizar a seguinte relação:
% = (V1/V) x 100
5% = (V1 / 200mL) x 100
V1 / 200mL = 5/100
V1 = 0,05 x 200
V1 = 10mL
Logo, o volume de peróxido de hidrogênio adicionado as roupas será de 10mL.
Gabarito: c) 10mL.
05 – (Ciência em Ação) Três (3,0) litros de uma solução aquosa de Ca(OH)2 contém 0,3mols do mesmo soluto. Dado: Ca = 40g/mol, O = 16g/mol, H = 1g/mol.
a) Qual a concentração em mol/L?
b) Qual a concentração em g/L?
Resolução
a) Para calcular a concentração molar precisamos conhecer o número de mols do soluto (0,3mols) e o volume da solução (3,0L), logo:
M = n / V
M = 0,3mols / 3,0L
M = 0,1mol/L
b) Já para a calcular a concentração comum devemos conhecer a massa do soluto e o volume da solução (3,0L).
Temos o número de mols do Ca(OH)2 e a partir da sua massa molar podemos encontrar sua massa em gramas.
MMCa(OH)2 = (1×40) + (2×1) + (2×16) = 74g/mol
Temos que:
n = m / MM
m = MM . n
m = 74g/mol x 0,3mols
m = 22,2g de Ca(OH)2
Para calcular a concentração comum utilizamos a seguinte fórmula:
C = m/V
C = 22,2g / 3,0L
C = 7,4g/L
Gabarito: a) 0,1mol/L; b) 7,4g/L.
06 – (UEG) Para o fertilizante sulfato de amônio (NH4)2SO4 recomenda-se a aplicação de 1 litro de solução com concentração 0,5mol/L de sulfato de amônio por m² de área plantada. A figura abaixo indica as dimensões de um terreno para plantação.
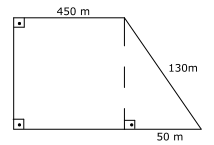
A massa de sulfato de amônio, em kg, que deverá ser utilizada para adubação desse terreno, é de aproximadamente:
a) 376kg b) 1132kg c) 3762kg d) 2850kg
Resolução
Gás Nobre, selecionei este exercício porque além do conteúdo de química sobre concentração de soluções ele aborda conhecimentos matemáticos sobre o cálculo de área. O bacana de resolver exercícios como esse é que você já vai treinando para vestibulares concorridos e o ENEM, pois questões de vestibular geralmente irão cobrar mais de um assunto ou até mesmo matéria em uma única questão.
Para calcular a área do terreno precisamos encontrar a altura do triângulo. Podemos fazer isso a partir da relação da hipotenusa com os catetos do triângulo retângulo:
h² = c² + c²
130² = 50² + c²
16900 = 2500 + c²
c² = 14400
c = 120m
Para encontrar a área do triângulo, temos:
Área = (b x h) / 2
Área = (50 x 120) / 2
Área = 3000m².
Para encontrar a área do retângulo, temos:
Área = b x h
Área = 450 x 120
Área = 54000m²
Área total = 3000 + 54000
Área total = 57000m²
Sabemos que deve ser utilizado 1L de solução 0,5mol de sulfato de amônio para cada 1m² de terreno, ou seja, serão utilizados 57000L desta solução.
Podemos utilizar a fórmula da concentração molar para encontrar a massa necessária para o preparo deste volume de solução nesta concentração:
M = m / MM . V
No entanto, precisamos conhecer a massa molar deste composto:
MM(NH4)2SO4= (2×14) + (8×1) + (1×32) + (4×16) = 132g/mol
Logo:
M = m / MM . V
0,5mol/L = m / (132g/mol x 57000L)
m = 3762000g (3762kg)
A massa de sulfato de amônio necessária para prepara solução suficiente para fertilizar o terreno é de 3762kg (alternativa c).
Gabarito: c) 3762kg.
Leia mais em:
Concentração das Soluções
Cálculo de Concentração de Soluções: Exercícios Resolvidos
07 – (UERJ) O sulfato de alumínio é utilizado como clarificante no tratamento de água, pela ação dos íons alumínio que agregam o material em suspensão. No tratamento de 450L de água, adicionaram-se 3,078kg de sulfato de alumínio, sem que houvesse variação de volume. Admitindo-se completa dissociação do sal, a concentração de íons alumínio, em mol/L, é igual a:
a) 0,02 b) 0,03 c) 0,04 d) 0,05
Resolução
Podemos calcular a concentração do sulfato de alumínio pela fórmula da concentração molar, mas primeiro, devemos conhecer sua massa molar:
MMAl2(SO4)3 = (2×27) + (3×32) + (12×16) = 342g/mol
Logo:
M = m / MM . V
M = 3078g / (342g/mol x 450L)
M = 0,02mol/L
Sabemos que para cada 1 mol de sulfato de alumínio temos 2 mols de Alumínio:
Al2(SO4)3(s) 🡪 2 Al3+(aq) + 3 SO42-(aq)
Portanto, a concentração de alumínio será o dobro da concentração de sulfato de alumínio, ou seja:
MAl = 0,04mol/L
Gabarito: c) 0,04mol/L.
Leia mais em: Tratamento de Água e Esgoto
Beleza Gás Nobre? Espero que tenha gostado dos exercícios selecionados e que eu tenha te ajudado a ficar ninja neste conteúdo. Não deixe de acompanhar nossas redes sociais para ter acesso a mais conteúdos exclusivos como este.
Gás Nobre, me conta ai nos comentários que outros conteúdos de química você gostaria de ver aqui na plataforma com uma seleção de exercícios resolvidos. Reage!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


