Raio atômico
O raio atômico é uma propriedade periódica e como o próprio nome diz, é o raio do átomo, ou seja, a distância do núcleo até o elétron mais externo de seus níveis eletrônicos. Mas como vamos determinar essa distância? É através da média aritmética da distância entre os núcleos de dois átomos. Para isso, basta dividir a distância entre os núcleos por 2. Veja a seguir:
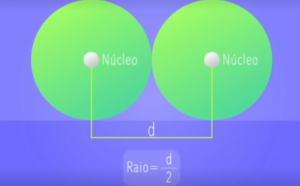
Para comparar o tamanho dos átomos, devemos levar em conta dois fatores:
– Número de níveis: quanto maior o número de níveis, maior será o tamanho do átomo (raio atômico).
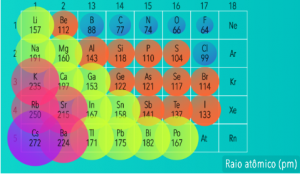
Note na figura acima, que o potássio (K) apresenta um raio maior que o sódio (Na)! Isso pois o “K” possui 3 níveis e o “Na” 2 níveis (menor raio). Mas se os átomos comparados apresentarem o mesmo número de níveis? Esse é o outro fator a ser analisado, veja:
– Número de prótons (número atômico): o átomo que apresenta maior número de prótons exerce uma maior atração sobre seus elétrons, o que ocasiona uma redução no seu tamanho. Portanto, quanto maior for a quantidade de prótons no núcleo, maior será a atração deles em relação aos elétrons, ocasionando em um átomo mais compacto.
Por exemplo, o lítio (Li) possui 3 prótons e o flúor (F) possui 9, enquanto que o número de camadas é o mesmo. Portanto o lítio tem o raio atômico maior, pois a atração entre a carga positiva do núcleo com a carga negativa dos elétrons é menor. Quanto maior o número de cargas, maior a atração.
↑Z = ↓Raio atômico
↓Z = ↑Raio atômico
Contudo temos que:
• Na mesma família: o raio atômico (tamanho do átomo) aumenta de cima para baixo na tabela, devido ao aumento do número de níveis;
• No mesmo período: o tamanho do átomo aumenta da direita para a esquerda na tabela, devido à diminuição do número de prótons nesse sentido, o que diminui a força de atração do núcleo sobre os elétrons.
Veja:

Ok? Mas o que acontece se o átomo perder ou ganhar elétrons tornando-se um íon?
Raio Iônico
O raio iônico está relacionado com a mudança no tamanho do átomo quando ele perde ou ganha elétrons. Logo, o raio iônico é o tamanho de um íon. Acontece que os prótons (partículas positivas) existentes no núcleo do átomo exercem uma força de atração sobre os elétrons (partículas negativas) presentes nas eletrosferas. Quanto maior for o número de prótons, maior será essa atração e vice-versa. Desta maneira, quando o número de elétrons é modificado seja pela perda ou ganho, a atração existente entre prótons e elétrons também se modifica.
Sendo assim, se o átomo perde elétron, ele se transforma em um cátion e consequentemente o seu tamanho diminui. Isso ocorre pois o número de elétrons nas eletrosferas passa a ser menor que o número de prótons no interior do núcleo, o que torna a força de atração do núcleo maior, atraindo mais para perto de si os elétrons das eletrosferas.
O raio de um cátion será sempre menor do que o raio do seu átomo neutro.
Raio do átomo neutro > Raio do cátion
Exemplo: Na+
Já quando ele ganha elétrons o seu tamanho aumenta, pois aumenta também a repulsão dos elétrons da última camada. O número de elétrons nas eletrosferas passa a ser maior do que o número de prótons no interior do núcleo. Nesse caso, a força de atração exercida pelo núcleo é superada pela força de repulsão entre os elétrons presentes nas eletrosferas.
O raio de um ânion será sempre maior do que o raio do seu átomo neutro.
Raio do átomo neutro < Raio do ânion
Exemplo: Cl–
Agora veja esse caso dos isoeletrônicos.
Os íons: 13Al3+ 12Mg2+ 11Na1+ 9F–
Note que ao perder ou ganhar os elétrons, todos ficam com 10 elétrons. Nesse caso, o que predomina é a quantidade de prótons, ou seja, a carga nuclear. Quanto maior essa carga, maior a atração dos elétrons com o núcleo e consequentemente menor o seu tamanho ou vice versa. Então o alumínio é o menor e o flúor é o maior.
Química em Ação


