Fala Gás Nobre, você já ouviu falar nas Teorias das Colisões? Você sabia que esta teoria se propõe a explicar como as reações químicas ocorrem e porque as velocidades destas reações variam de uma pra outra. Ficou interessado? Então bora reagir.
Essa teoria foi proposta pelos químicos Max Trautz e William Lewis no início do século XX, essa teoria diz que para que uma reação química ocorra, as partículas (átomos, íons, moléculas…) dos reagentes devem colidir entre si, mas que esta colisão deve ser efetiva, isto é, deve ser feita em uma orientação adequada e com energia suficiente.
A colisão entre as partículas, ou choque efetivo, deve ser bem orientada, permitindo uma perfeita interação entre as partículas. Mas na maioria dos casos, apenas as colisões não são suficientes para que a reação ocorra, pois as partículas que se chocam não possuem energia suficiente.
Por exemplo, o gás oxigênio presente no ar atmosférico participa como comburente na reação de combustão do gás de cozinha, no entanto, apenas abrir o fogareiro, permitindo o contato entre o gás de cozinha e o oxigênio, não faz com que a reação ocorra, faz necessário o uso de uma chama ou descarga elétrica pra ignição, ou seja, a reação necessita de uma energia de ativação (Ea).
A energia de ativação (Ea) é a energia mínima necessária que deve ser fornecida para que os reagentes possam romper suas ligações e formarem novas, formando novos produtos.
Em resumo, esta teoria explica como reações acontecem, no entanto, devemos frisar que se faz necessária a presença de alguns fatores, como:
– Deve haver contato entre as partículas;
– Deve existir afinidade química entre as partículas;
– As partículas devem colidir-se entre si;
– As partículas devem se colidir com orientação favorável e energia suficiente (Ea).
Considerando que as partículas em questão estão em contato e que há afinidade química entra elas, o próximo fator determinante seria a orientação do contato. Vamos tomar como exemplo a reação entre 2 partículas diatômicas, o H2 e o I2, na reação de formação do HI.
H2 + I2 HI + HI
O quadro abaixo exemplifica qual o tipo de colisão que seria efetiva para a reação entre o H2 e o I2:
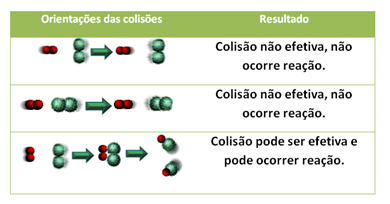
O último fator determinante é se a reação possui energia suficiente (energia de ativação) para que as colisões geometricamente favoráveis de fato ocorram. Se todos esses requisitos forem cumpridos, têm-se então a ocorrência da reação química.
Quando ocorre a colisão entre partículas numa geometria favorável e com energia suficiente, forma-se primeiro uma substância intermediária entre os reagentes e os produtos, denominada complexo ativado.
Na imagem abaixo, podemos ver a colisão entre as moléculas H2 e I2 e o complexo ativado formado entre elas:
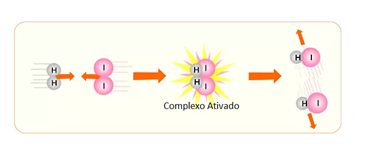
Sendo assim, quanto maior for a energia necessária para a formação do complexo ativado, mais lenta será a reação e mais dificilmente será para ela ocorrer.
Vale ressaltar que a velocidade de uma reação é diretamente proporcional ao número de colisões favoráveis, ou seja, qualquer fator que aumente o número deste tipo de colisão aumentará a rapidez (velocidade) com que a reação ocorre.
Por exemplo, se aumentarmos a temperatura do sistema, aumentamos a energia cinética das moléculas do mesmo e consequentemente, aumentamos o número de colisões acontecendo e a velocidade da reação.
A imagem a seguir representa a reação entre 2 substâncias genéricas, A2 e B2, mostrando a energia de ativação necessária para a formação do complexo ativado e a formação do produto AB:
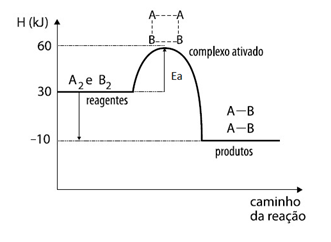
Ficou interessado no assunto de velocidade das reações? Veja mais sobre assistindo nossa playlist no Youtube sobre Cinética Química.
Leia mais em:
Velocidade Média das Reações
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


