Fala Gás Nobre, tudo bem? Preparado para reagir? Nesse artigo vamos falar sobre termodinâmica, conceitos, leis e fórmulas, além de analisar dois exercícios super interessantes sobre o tema.
TERMODINÂMICA E A FÍSICA
Pois é, Gás Nobre, a termodinâmica vem ser uma área da Física, mas para a Química, essa disciplina também é muito importante, pois estuda as transferências de energia, através de uma análise da relação entre calor, trabalho e energia.

Historicamente, essa área surge quando tivemos uma necessidade de aumentar a eficiência das máquinas a vapor, no período da Revolução Industrial, que diga-se de passagem, o professor de Física Ueslei fez um vídeo super legal falando sobre isso. Se por acaso você ainda não assistiu essa aula, clique aqui:
CONCEITOS FUNDAMENTAIS
Gás Nobre, para abordarmos a Termodinâmica alguns conceitos são bastante importantes, e estes são: calor, energia e temperatura. Então vamos ver o que cada um deles significa?
- Calor: termo relacionado com a troca de energia térmica entre partes de um mesmo sistema, ou entre sistemas diferentes;
- Energia: capacidade de realizar ação/trabalho;
- Temperatura: o que mede o grau de agitação das moléculas;
As condições de um sistema termodinâmico, podem ser descritos através de parâmetros como a pressão, temperatura e volume. Sabendo disso, temos que alterações nesses parâmetros podem ocorrer, e outros termos comuns de se aparecer nessa temática, tornam-se necessários de mencionar:
- Transformação Adiabática: transformação em que não há troca de calor com o ambiente;
- Transformação isotérmica: transformação que ocorre em temperatura constante;
- Transformação isobárica: transformação que ocorre em pressão constante;
- Transformação isocórica (ou isovolumétrica): transformação que ocorre em volume constante;
Agora que já vimos esses conceitos, vamos estudar as Leis da Termodinâmica?
AS LEIS DA TERMODINÂMICA
Existem 4 Leis da Termodinâmica:
- Lei Zero da Termodinâmica (Equilíbrio Térmico)
Corpos em contato térmico terão troca de calor entre si até ser alcançado um estado de equilíbrio térmico.
- Primeira Lei da Termodinâmica (Conservação de Energia)
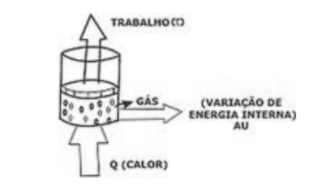
A energia não pode ser criada e nem destruída, apenas transformada. Essa transformação estabelece uma equivalência entre calor e trabalho, o que pode ser representado pela fórmula:
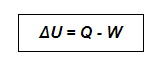
Onde:
ΔU → Variação da Energia Interna
Q → Quantidade de Calor
W → Trabalho
- Segunda Lei da Termodinâmica (Entropia)
A entropia (desordem de um sistema termodinâmico) de um sistema isolado tende sempre ao aumento.
Isso explica a razão que um corpo mais frio (menor entropia) não consegue transferir calor para um corpo mais quente (maior entropia), mas sim, o contrário é o que ocorre.
- Terceira Lei da Termodinâmica (Temperatura do Zero Absoluto)
É impossível reduzir a temperatura de um sistema ao Zero Absoluto, onde a entropia de uma substância pura tenha a sua entropia com valor próximo a zero.
Exercício 1
Numa transformação isobárica, um gás aumentou de volume realizando um trabalho de 2 Joules sobre a vizinhança. Durante o processo, o gás recebeu 5 Joules de calor do ambiente. Determine a variação da energia interna do gás.
Resolução:
Sabemos que:
Q ➔calor que o gás recebeu do ambiente = 5 J
W ➔trabalho que o gás realizou sobre a vizinhança = 2 J
ΔU ➔variação de energia interna do gás
Determinando a variação de energia interna do gás:
∆𝑈 = 𝑄 − 𝑊
∆𝑈 = 5 − 2
∆𝑈 = 3 𝐽
Logo, a variação de energia interna do gás foi igual a 3 Joules.
OBS.: Em geral, num sistema termodinâmico, temos que:
Q> 0 ➔ O sistema recebeu calor do meio externo;
Q < 0 ➔ O sistema cedeu calor para o meio externo;
Q = 0 ➔ O sistema não fez troca de calor com o meio externo (transformação adiabática)
ΔU > 0 ➔ A energia interna do sistema aumenta, logo a temperatura do sistema também aumenta;
ΔU < 0 ➔ A energia interna do sistema diminui, logo a temperatura do sistema também diminui;
ΔU = 0 ➔ Não há variação de energia interna no sistema, logo a temperatura não se altera (transformação isotérmica);
W > 0 ➔ O sistema realiza trabalho sobre o meio externo;
W < 0 ➔ O meio externo realiza trabalho sobre o gás;
W = 0 ➔ Não há realização de trabalho pelo gás e nem sobre o gás, logo o volume não se altera (transformação isocórica);
TRABALHO DE UM GÁS
Uma das formas de se calcular o trabalho realizado entre o sistema e o meio externo, pode ser feito quando identificamos que a pressão do sistema (em nosso caso o gás) é constante. E nesse caso teremos:
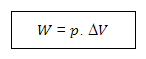
Onde:
W ➔ energia, em forma de trabalho, trocada entre o sistema e o meio externo
P ➔pressão interna do gás
ΔV = Vf – Vi➔variação de volume do gás
Exercício 2
Num processo à pressão constante de 1,0.105 Pa, um gás aumenta o seu volume de 9.10-4 m3 para 14.10-4 m3 . Determine o trabalho realizado pelo gás, em joules.
Resolução
Sabemos que:
W ➔trabalho realizado pelo gás
P➔ pressão interna do gás = 1,0.105 Pa
ΔV = Vf – Vi = 14.10-4 – 9.10-4= 5.10-4 m3➔variação de volume do gás
Determinando o trabalho realizado pelo gás:
𝑊 = 𝑃. ∆𝑉
𝑊 = 1. 105 . 5. 10−4
𝑊 = 5. 105 . 10−4
𝑊 = 5. 105+(−4)
𝑊 = 5. 101
𝑊 = 50 𝐽
Logo, o trabalho realizado pelo gás é igual 50 Joules.
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


