Fala Gás Nobre, vamos ver alguns exercícios sobre polaridade de moléculas e o passo a passo de como resolvê-los para que você fique ninja nesse assunto e possa ir super bem no ENEM. Bora lá?
Antes de resolvermos os exercícios vamos falar um pouco sobre esse assunto, sobre o que é a polaridade de uma ligação química e a polaridade de uma molécula.
Entende-se por polaridade a capacidade que as ligações possuem de atrair cargas elétricas, ou seja, de concentrar uma densidade de carga elétrica. O local onde ocorre este acúmulo de densidade de carga chamamos de pólos, por isso, daí vem o termo polaridade, que é a capacidade de formar pólos. Estes pólos ainda podem ser positivos ou negativos, dependendo da carga que possuem.
Primeiro discutiremos a polaridade presente nas ligações químicas e depois a polaridade das moléculas, que dependem não apenas da polaridade das ligações que possui, mas também da sua geometria molecular.
Leia mais em:
Aula: Geometria Molecular
Conceitos e Teoria RPECV
Vamos falar do tipo de polaridade presente nas ligações iônicas e covalentes.
Ligação Iônica
Compostos químicos com este tipo de ligação são formados pela ligação de um elemento metálico com um ou mais elementos do tipo ametal. Neste tipo de ligação a transferência de elétrons é definitiva e por isso, os compostos iônicos são formados por íons carregados positivamente (cátions) e negativamente (ânions). Portanto, devido ao fato de serem formados por íons carregados, estes compostos apresentam pólos, ou seja, possuem ligações polares.
Em resumo, toda ligação iônica é uma ligação polar.
Leia mais em:
Aula: A ligação iônica
Ligação Iônica
Ligações Iônicas no nosso cotidiano
Ligação Covalente
Compostos com este tipo de ligação são formados pela ligação entre átomos de hidrogênio entre si (H2), átomos de hidrogênio e elementos classificados como ametais na tabela periódica e ametais ligados a si ou a outros ametais.
Leia mais em:
Aula: A ligação covalente
Ligações Covalentes no nosso cotidiano – Parte I
Ligações Covalentes no nosso cotidiano – Parte II
A existência ou não de pólos nesse tipo de ligação está associada à eletronegatividade dos elementos que a constituem.
Se a ligação covalente ocorre entre átomos de mesma eletronegatividade, ou seja, entre átomos do mesmo elemento químico, a ligação é apolar. Apolar (a = sem, polar = pólos) pois não há formação de pólos, trata-se de uma ligação entre elementos de mesma negatividade.
Os principais exemplos são as moléculas diatômicas como: H2, F2, O2, N2, Cl2, Br2, etc…
No entanto, se a ligação covalente for entre átomos com eletronegatividade diferentes, a ligação será polar. A diferença de eletronegatividade induz o acúmulo de carga negativa ao redor do elemento mais eletronegativo, gerando assim uma densidade de cargas numa região da ligação, ou seja, formando um pólo.
Para melhor compreender essa diferença de eletronegatividade entre esses elementos trago aqui uma escala em ordem decrescente de eletronegatividade. Vale lembrar que a eletronegatividade é a tendência em receber elétrons, ou seja, quanto mais eletronegativo um elemento maior será sua tendência em receber ou até mesmo roubar elétrons dos demais.
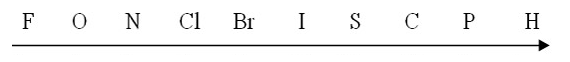
Gás Nobre, na escala podemos observar que o flúor (F) é o elemento mais eletronegativo, ou seja, o que possui maior capacidade de acumular e atrair cargas negativas. Já o hidrogênio (H) é o menos eletronegativo.
Existe um macete muito útil para ajudar a lembrar a ordem de eletronegatividade destes elementos, que é o seguinte:

As letras destacadas representam os elementos em escala decrescente de eletronegatividade. Do flúor, mais eletronegativo, ao hidrogênio, menos eletronegativo.
Leia mais em: Mapa Mental sobre eletronegatividade
Quanto maior for a diferença de eletronegatividade entre os elementos presentes na ligação, maior será a polaridade da mesma.
Por exemplo, a molécula de água (H2O) é formada por 1 átomo de oxigênio ligado a 2 átomos de hidrogênio. De acordo com a escala de eletronegatividade, o oxigênio é o segundo elemento mais eletronegativo e o hidrogênio o menos. Desta forma, as ligações entre o oxigênio e os átomos de hidrogênio formam pólos, portanto, serão polares.
No entanto, no caso do metano (CH4), temos 1 átomo de carbono ligado a 4 átomos de hidrogênio e de acordo com a escala de eletronegatividade, estes elementos possuem valores de eletronegatividade parecidos. Por possuírem valores próximos de eletronegatividade a ligação formada por estes elementos será considerada apolar, pois não observa-se formação de uma densidade de cargas em um destes elementos, ou seja, não há formação de pólos.
De forma geral, podemos resumir que compostos iônicos vão sempre possuir uma ligação polar forte e os covalentes possuem ligações polares ou apolares, dependendo dos elementos envolvidos na mesma.
Gás Nobre, é importante no caso dos compostos que possuem apenas ligações covalentes avaliar não apenas a polaridade das ligações, mas da molécula como um todo. A geometria molecular pode definir se um determinado composto é polar ou apolar. Em alguns casos, compostos com ligações polares podem ser apolares devido a sua geometria e por isso, vamos ver brevemente sobre isso a seguir:
A polaridade de uma molécula está relacionada à distribuição dos elétrons ao redor dos átomos. Se esta distribuição for simétrica, a molécula será apolar, mas se for assimétrica, sendo que uma das partes da molécula possui maior densidade eletrônica, então trata-se de uma molécula polar.
Desta forma, a polaridade de uma molécula é dada pela diferença de eletronegatividade entre os átomos que a constituem e sua geometria.
Eletronegatividade
Se a molécula é formada por ligações entre números pares de átomos dos mesmos elementos químicos, ou seja, substâncias simples, tais como: H2, O2, Cl2, Br2, N2, P4, S8, entre outras. Elas serão apolares, pois não há diferenças de eletronegatividade entre seus átomos.
No entanto, se a molécula é diatômica (formada por 2 átomos) e formada por elementos diferentes, então a molécula será polar, devido a diferença de eletronegatividade entre os elementos que a constituem. São exemplos: HCl, HF, HBr e HI.
Geometria
A geometria da molécula nos diz como os elétrons, ligantes ou não, estão distribuídos nela e, consequentemente, sua polaridade. Se a molécula é formada por 3 átomos ou mais, temos que avaliar a diferença de eletronegatividade entre seus átomos constituintes e sua geometria.
Por exemplo, o CO2 e a H2O, ambos são formados por 3 átomos, com 1 átomo central ligado a 2 átomos iguais de outro elemento. A diferença de eletronegatividade entre o carbono (C) e o oxigênio (O) e entre o oxigênio (O) e o hidrogênio (H) são altas, ou seja, trata-se de ligações polares em ambas as moléculas.
No entanto, a geometria do CO2 é linear enquanto que a da H2O é angular. Em ambas as moléculas teremos uma densidade de cargas no oxigênio. Na molécula de CO2 observamos o seguinte:
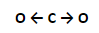
Como cada oxigênio realiza um mesmo deslocamento de cargas em direções opostas temos a anulação destas forças, ou seja, apesar de termos ligações polares, a molécula é APOLAR, pois seus pólos se anulam.
Já para a água, observamos o seguinte:
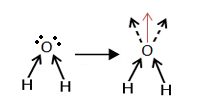
Vamos observar a formação de um vetor resultante da densidade de cargas atraída dos átomos de hidrogênio pelo átomo do oxigênio, ou seja, temos a formação de um pólo e portanto, a molécula da água é POLAR.
Desta forma, moléculas com geometria simétrica (e mesmos ligantes) sempre serão APOLARES e moléculas com geometria assimétrica sempre serão POLARES.
Pronto, agora que fizemos uma revisão geral sobre o assunto, vamos por em prática o que discutimos até aqui. Bora praticar?
01 – (Mackenzie) O aumento de diferença de eletronegatividade entre os elementos ocasiona a seguinte ordem no caráter das ligações:
a) covalente polar, covalente apolar, iônica.
b) iônica, covalente polar, covalente apolar.
c) covalente apolar, iônica, covalente polar.
d) covalente apolar, covalente polar, iônica.
e) iônica, covalente apolar, covalente polar.
Resolução
Gás Nobre, moléculas formadas por elementos com eletronegatividade parecidas ou muito próximas não irão gerar diferença de polaridade, portanto, formaram compostos com ligações covalentes apolares. Se aumentarmos a diferença de eletronegatividade, seguindo a escala apresentada na revisão deste conteúdo, vamos ter então a formação de compostos com ligações covalentes polares, pois teremos a formação de pólos devido a esta diferença de eletronegatividade. Se continuarmos aumentando esta diferença, teremos os compostos iônicos, que são formados por íons carregados positivamente e negativamente, ou seja, apresentam a maior diferença possível de eletronegatividade.
Portanto, a ordem crescente de polaridade de ligações seria: covalente apolar, covalente polar e iônica.
R: d) covalente apolar, covalente polar e iônica.
02 – (FESP) As ligações químicas existentes na formação das substâncias KCl, HCl e Cl2, são respectivamente: (Números atômicos: H = 1; Cl = 17; K = 19)
a) covalente polar, iônica e covalente apolar.
b) covalente polar, covalente apolar e iônica.
c) covalente apolar, covalente polar e iônica.
d) iônica, covalente apolar e covalente polar.
e) iônica, covalente polar e covalente apolar.
Resolução
Gás Nobre, temos aqui 3 moléculas diatômicas, ou seja, formadas pela ligação entre 2 átomos. No caso do KCl, temos um metal (K) ligado a um ametal (Cl), ou seja, trata-se de uma ligação iônica, onde o potássio (K) é o íon positivo (K+) e o cloro (Cl) é o íon negativo (Cl-). Já no caso do HCl, temos uma ligação entre um átomo de hidrogênio e um ametal, ou seja, trata-se de uma ligação covalente. Se observarmos a escala de eletronegatividade, podemos concluir que a diferença entre ambos é grande, ou seja, teremos a formação de um pólo, logo, trata-se de uma ligação covalente polar. Por fim, temos o Cl2, que é uma ligação entre 2 átomos de um mesmo elemento, ou seja, não temos diferença de eletronegatividade entre eles e portanto, trata-se de uma ligação covalente apolar.
Portanto, a ordem correta é: iônica, covalente polar e covalente apolar.
R: e) iônica, covalente polar e covalente apolar.
03 – (UFTM) Os gases amônia, dióxido de carbono e trióxido de enxofre são insumos importantes na indústria química. Em relação à polaridade de suas moléculas, é correto afirmar que NH3, CO2 e SO3 são, respectivamente,
a) polar, polar e apolar.
b) polar, apolar e polar.
c) polar, apolar e apolar.
d) apolar, polar e apolar.
e) apolar, apolar e polar.
Resolução
Gás Nobre, é muito importante conhecer a geometria destas moléculas que comumente aparecem no ENEM. Sugiro a leitura de um post que fiz aqui no blog sobre Geometria Molecular para que você fique ninja nesse assunto.
Pela escala de eletronegatividade, todas as ligações presentes nos 3 compostos são polares, devido à diferença de eletronegatividade entre nitrogênio e hidrogênios da amônia (NH3), entre carbono e oxigênios no CO2 e entre o enxofre e os oxigênios no SO3.
No entanto, temos que analisar a geometria destes compostos para saber se a mesma é simétrica ou não e, portanto, apolar ou polar.
Como visto anteriormente, a geometria do CO2 é linear, ou seja, simétrica e, portanto, apolar, pois os pólos formados pelas ligações entre carbono e oxigênio se anulam. O SO3 apresenta geometria trigonal plana, também simétrica e, portanto, apolar. Já a amônia apresenta geometria piramidal, que possui assimetria devido a presença do par de elétrons não ligantes do nitrogênio e devido a isso, apresenta um pólo e, portanto, trata-se de uma molécula polar.
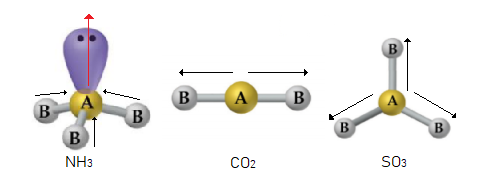
Portanto, a resposta correta é NH3 polar, CO2 apolar e SO3 apolar.
R: c) polar, apolar e apolar.
Leia mais em: Mapa mental sobre polaridade das moléculas que mais caem no ENEM
04 – (IME) Os compostos FeO, NO, F2, NaCl e HCl apresentam, respectivamente, os seguintes tipos de ligações:
a) iônica, covalente apolar, metálica, iônica e covalente polar.
b) covalente polar, covalente polar, covalente apolar, iônica e molecular.
c) metálica, iônica, covalente pura, molecular e iônica.
d) iônica, covalente polar, covalente apolar, iônica e covalente polar.
e) iônica, covalente apolar, covalente apolar, iônica e iônica.
Resolução:
Gás Nobre, nos compostos FeO e NaCl temos uma ligação entre um elemento metálico (Fe-ferro, Na-sódio) e um ametal (O-oxigênio, Cl-cloro), logo, trata-se de uma ligação iônica. No composto F2, temos uma ligação covalente, pois o flúor é um ametal, como não há diferença de eletronegatividade entre átomos de um mesmo elemento, trata-se de uma ligação covalente apolar, sem formação de pólos. Já nos compostos NO e HCl, temos uma ligação entre elementos ametais diferentes, ou seja, que possuem valores de eletronegatividade diferentes, logo, formam ligações covalentes com formação de densidade de cargas sobre o elemento mais eletronegativo, que será o oxigênio (O) na molécula de NO e o cloro (Cl) no HCl, portanto, formam ligações covalente polares.
Então temos que: FeO – iônica, NO – covalente polar, F2 – covalente apolar, NaCl – iônica e HCl – covalente polar. Ou seja, a alternativa correta é a letra d.
R: d) – iônica, covalente polar, covalente apolar, iônica e covalente polar.
05 – (ESPCEX) O carvão e os derivados do petróleo são utilizados como combustíveis para gerar energia para maquinários industriais. A queima desses combustíveis libera grande quantidade de gás carbônico como produto. Em relação ao gás carbônico, são feitas as seguintes afirmações.
I. É um composto covalente de geometria molecular linear.
II. Apresenta geometria molecular angular e ligações triplas, por possuir um átomo de oxigênio ligado a um carbono.
III. É um composto apolar.
Das afirmativas apresentadas está(ão) correta(s):
a) Apenas I.
b) Apenas I e II.
c) Apenas I e III.
d) Apenas II e III.
e) Todas.
Resolução
Gás Nobre, aproveitando a contextualização desta questão vou aproveitar para te dar uma dica super bacana sobre polaridade de moléculas. De forma geral, compostos contendo carbono, moléculas orgânicas derivadas do petróleo, com longas cadeias carbônicas, serão apolares.
Agora voltando à questão, nosso foco é a molécula de CO2, liberada na queima de combustíveis fósseis. O CO2 é uma molécula de geometria linear que possui o carbono como átomo central fazendo 2 duplas ligações com átomos de oxigênio (O=C=O). Como já vimos em questões anteriores, trata-se de uma molécula apolar, pois os pólos de suas ligações polares entre C e O se anulam.
Logo, apenas as alternativas I e III estão corretas, ou seja, letra c.
R: c) Apenas I e III.
Gás Nobre, espero ter ajudado a melhor compreender os conceitos por trás da polaridade das ligações entre os átomos constituintes de uma molécula e da polaridade da molécula como um todo. Não deixe de treinar outros exercícios sobre esse tema e de dar uma olhada nas sugestões de leitura que deixei ao longo deste texto. Reage!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


