Fala Gás Nobre, hoje vamos falar sobre o que você precisa saber sobre 3 importantes grandezas físicas, que são a pressão, a temperatura e o volume.
Mas o que são grandezas físicas?
Nas Ciências da Natureza (Biologia, Física e Química) as chamadas grandezas físicas são as propriedades mensuráveis de um fenômeno, corpo ou substância. Ou seja, são propriedades que podem ser expressas quantitativamente, isto é, de maneira numérica.
As grandezas físicas podem ser divididas entre escalares e vetoriais.
As escalares são mensuradas por meio de um número (magnitude ou módulo) e de uma referência de tamanho (unidade de medida), isto é, são grandezas cujos valores estão contidos em uma escala.
Já as vetoriais são mensuradas por meio de um número (magnitude ou módulo), de uma referência de tamanho (unidade de medida) e de uma orientação (direção e sentido).
São grandezas físicas todas as propriedades que podem ser medidas de um fenômeno corpo ou substância. Por exemplo, para a água, são consideradas grandezas físicas: a sua temperatura (de fusão e de ebulição), densidade, entalpia de formação, condutividade térmica, entre outros. Já de um corpo composto de água, são: o seu volume, sua temperatura, sua massa, entre outros.
No post de hoje abordaremos 3 importantes grandezas físicas, que são: a Temperatura, a Pressão e o Volume. Vamos falar de cada uma delas a seguir:
Temperatura
Temperatura é uma grandeza física que mede a energia cinética média das partículas de um corpo. Isto é, mede o grau médio de agitação das partículas deste corpo. Corpos com elevada temperatura apresentam maior agitação de partículas se comparado a corpos mais frios.
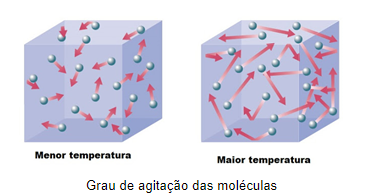
Essa definição de temperatura também se aplica para gases, uma vez que a temperatura de um gás é proporcional ao quão rápido suas partículas estão se movendo.
Observamos isso também nas mudanças de estados físicos da matéria, onde o aumento da temperatura de um sólido, por exemplo, resulta no aumento da agitação das suas partículas e em um dado valor de temperatura, essas partículas possuem tal energia cinética que diminuem a atração entre si e a substância acaba mudando para o estado líquido. O inverso também é observado, por exemplo, se resfriamos um gás, em dada temperatura suas partículas terão perdido tanta energia cinética que irão interagir mais entre si e a substância passa para o estado líquido.
As temperaturas em que ocorrem estas mudanças de estado são tão importantes e estudadas que possuem nomenclatura própria. São consideradas propriedades específicas de cada substância, sendo chamadas de temperatura de fusão, no caso da mudança sólido-líquido e temperatura de ebulição para a mudança líquido-gasoso.
Além do mais, o fato de que as temperaturas de fusão e ebulição são propriedades específicas das substâncias, nos permite utilizá-las em processos de separação de misturas. Por exemplo, uma mistura de água e álcool, são 2 líquidos incolores totalmente miscíveis, isto é, se misturam completamente. No entanto, apresentam diferentes temperaturas de ebulição (água = 100ºC e álcool = 78,3ºC), logo, podem ser separados por aquecimento, num processo chamado de destilação simples. Já para misturas mais complexas podemos utilizar a destilação fracionada.
Leia mais em:
Mudanças de Estado Físico da Matéria
Temperatura de Fusão e Ebulição
Separação de Misturas – Parte II
Devido à sua relação com o grau de agitação das partículas, a temperatura é um importante objeto e parâmetro de estudo em diversas áreas da física e da química. Entre elas estão a Termodinâmica e a Cinética Química, além de diversos estudos envolvendo gases.
Na Termodinâmica estuda-se energia das reações químicas, usando muitas vezes como parâmetro de medida da quantidade de calor liberado a variação de temperatura de um sistema.
Na Cinética Química, estudam-se os fatores que influenciam na velocidade de uma reação e a temperatura é um deles. Segundo a teoria das colisões, quanto maior o número de colisões efetivas entre partículas maior a chance de formar produtos, logo, quanto maior a temperatura, maior a agitação das partículas, maior a chance de acontecerem colisões efetivas e formar os produtos desejados.
Leia mais em:
Termodinâmica: Leis, Conceitos, Fórmulas e Exercícios
Teoria das Colisões
Taxas de Reação e Leis de Velocidade
Outro fator diretamente relacionado à temperatura é o deslocamento de equilíbrio químico. O aumento ou diminuição de temperatura irão deslocar o equilíbrio da reação para a formação de produtos (reação direta) ou para a formação de reagentes (reação inversa).
Leia mais em: Deslocamento de Equilíbrio Químico
Existem diversas escalas de temperatura, sendo a escala em graus Celsius (ºC) a mais comumente utilizada. No entanto, a escala de temperatura no Sistema Internacional de Medida (SI) é a escala em graus Kelvin (K). A conversão entre essas 2 escalas é dada pela seguinte fórmula:
Kelvin (K) = Celsius(ºC) + 273
Por exemplo, quanto é 20ºC em Kelvin?
T (Kelvin) = T (Celsius) + 273
T (Kelvin) = 20 + 273
T (Kelvin) = 293K
A escala Kelvin é mais apropriada para o uso científico uma vez que não apresenta valores negativos de temperatura. Isso acontece, pois a temperatura de 0 K (Zero Kelvin) é equivalente à temperatura denominada de zero absoluto, a qual diversos cientistas acreditam que é a temperatura onde cessam todas as agitações e movimentações das partículas de qualquer material.
No entanto, alcançar o zero absoluto é um verdadeiro desafio científico, diversos pesquisadores do mundo inteiro estão na sua busca, mas até hoje, não obtiveram êxito.
Pressão
Pressão é a força exercida por unidade de área, isso é, a razão entre uma força aplicada e a área sobre a qual ela está sendo exercida. Por exemplo, a pressão dentro dos pneus dos carros é gerada pela força dos gases sobre a superfície interna dos pneus.
Outros exemplos de pressão são a pressão atmosférica, que é a força exercida pelo ar atmosférico sobre a superfície terrestre, ou o estouro de um balão de festa se o enchermos demais, que ocorre pois a pressão interna tornou-se demasiadamente grande e a força realizada sobre a superfície ocasiona seu rompimento.
Assim como a temperatura, existem mais de uma unidade, sendo as mais utilizadas: milímetros de mercúrio (mmHg), atmosfera (atm) e Pascal (Pa).
Elas também possuem relação entre si, podendo ser convertidas uma nas outras.
1 atm = 760 mmHg = 101325 Pa
Assim como a temperatura, a pressão influencia nas mudanças de estado físico da matéria, na cinética das reações e no deslocamento do equilíbrio.
Se aumentarmos a temperatura aumentamos o grau de agitação das partículas, no entanto, se diminuirmos a pressão, também obtemos esse mesmo resultado, mas por quê? Isso ocorre porque se diminuímos a pressão, diminuímos a força aplicada sobre essas partículas, deixando-as mais “livres”, se o grau de agitação aumenta, a interação entre elas diminui e ocorre a mudança de estado físico.
O efeito contrário também pode ser obtido, se aumentarmos a pressão, aumentamos a força aplicada sobre essas partículas e consequentemente a interação entre elas, podendo ocasionar sua mudança de estado físico, dependendo da pressão aplicada.
Já no caso da cinética e equilíbrio das reações químicas vamos exemplificar utilizando reações envolvendo substâncias gasosas. Por exemplo, uma reação entre substâncias líquidas que formam substâncias gasosas, se aumentarmos a pressão do sistema haverá maior força aplicada sobre estas partículas e o equilíbrio será deslocado para os reagentes, no entanto, se temos o inverso, uma reação entre gases formando compostos líquidos ou sólidos, se aumentarmos a pressão, vamos aumentar a interação entre as moléculas gasosas e consequentemente aumentaria a velocidade da reação e o deslocamento do equilíbrio para a formação de produtos.
Volume
O volume de um corpo é a quantidade de espaço ocupada por ele. O volume pode ser dado por unidades de tamanho cúbico, como por exemplo, m³, dm³ e cm³ ou em litros (L) e mililitros (mL).
Essas unidades possuem relação entre si e podem ser convertidas umas nas outras, conforme relações abaixo.
1 m³ = 1000L = 1000 dm³;
1 L = 1 dm³ = 1000 cm³ = 1000 mL;
O volume constitui uma importante grandeza física para a física, química e matemática. Na matemática, estuda-se e determina-se formas de calcular o volume de diferentes estruturas espaciais, havendo até mesmo fórmulas bem definidas para realizar o cálculos de algumas destas estruturas, sejam elas esféricas, cônicas, piramidais, cúbicas, entre outras.
Já na física, usa-se o volume principalmente no estudo dos gases, da expansão e compressibilidade, uma vez que um gás assume o volume do recipiente que o ocupa. Desta forma, o volume, juntamente com a pressão e a temperatura, fazem parte do estudo dos gases, estando presentes na equação geral dos gases.
PV = nRT
Onde,
P = Pressão
V = Volume
T = Temperatura
n = número de mols
R = Constante universal dos gases ideais
Leia mais em: Teoria Cinética Molecular e o Estudo dos Gases
Por fim, na química, o volume é uma propriedade muito importante no estudo de soluções, uma vez que a grande maioria dos tipos de concentrações utilizados são dependentes dos volumes das mesmas. Por exemplo, a concentração comum, determina a quantidade de matéria, em gramas, de um soluto em determinado volume, em litros, de uma solução, já a concentração molar, determina a quantidade de matéria, em mols, de um soluto em determinado volume, em litros, de uma solução.
Leia mais em: Concentração das Soluções
Outra aplicação do volume é na determinação da densidade de uma substância, pois a densidade é dada pela massa, em gramas, de uma amostra de volume igual a 1cm³ de uma substância. Isto é, a densidade é a relação entre a massa e o volume de um corpo, sendo dada pela massa referente ao volume de 1cm³/1mL (d = g/cm³). Por exemplo, a massa de 1mL de água é igual a 1g, logo, sua densidade é igual a 1g/mL (1g/cm³).
Leia mais em: Densidade
Beleza Gás Nobre? Esse foi um super resumo sobre Temperatura, Pressão e Volume, com tudo o que você precisa saber sobre definições, aplicações, unidades de medidas e suas conversões, para você detonar no ENEM. Reage!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


