Fala Gás Nobre, hoje vamos falar do Princípio de Avogadro, que surgiu a partir da sua hipótese de que “volumes iguais, de quaisquer gases, nas mesmas condições de temperatura e pressão, apresentam a mesma quantidade de matéria, ou seja, o mesmo número de mols ou partículas”.
Amedeo Avogadro (1776-1856) foi um físico e químico italiano, que em 1811 publicou um artigo no Journal de Physique, importante revista científica da época, onde apresentava sua hipótese de que:
“Volumes iguais, de quaisquer gases, nas mesmas condições de temperatura e pressão, apresentam a mesma quantidade de matéria, ou seja, o mesmo número de mols ou partículas”.
Esta hipótese seria uma forma de expressar uma lei de conservação volumétrica, baseada nos estudos e na Lei Volumétrica de Gay-Lussac, que futuramente viria a ser chamada de Lei ou Princípio de Avogadro.
Leia mais em: Lei Volumétrica
A Lei de Avogadro é um conjunto de leis matemáticas que trata da quantidade de matéria em gases a diferentes temperaturas. Esta lei leva em conta que os gases são extremamente expansíveis e que devido a isso suas moléculas ocupam todo o espaço disponível no recipiente que os contém. Ou seja, considera o volume do gás correspondente à capacidade do recipiente onde está contido.
Avogadro previu que volumes iguais de gases na mesma temperatura e pressão possuíam a mesma quantidade de matéria, ou seja, o mesmo número de partículas. No entanto, infelizmente Avogadro faleceu antes de conseguir determinar que número fosse esse.
Porém, com os avanços tecnológicos do século XX, este número pode ser determinado e foi atribuído o nome de “Constante de Avogadro” em sua homenagem.
Leia mais em: O mol e a constante de Avogadro: Como fazer os cálculos
Uma dessas determinações experimentais do número de Avogadro foi realizada por Robert Millikan (1868-1953), num experimento que determinou a carga de 1 único elétron como 1,6 . 10-19C. Nesta época, a carga de 1mol de elétrons já era conhecida, com o valor de 96500C, podendo assim ser determinado o número de elétrons presentes em 1 mol pela seguinte relação:
Número de mol = 96500C / 1,6 . 10-19C
Número de mol = 6,03 . 1023 elétrons
Lembrando que o número de Avogadro representa um 1 mol de quaisquer partículas, sejam átomos, moléculas, íons, prótons, nêutrons e elétrons. Poderíamos utilizar o número de mols para representar objetos do dia a dia, no entanto, o número de Avogadro é da ordem de 1023 (603000000000000000000000 partículas), sendo um número ABSURDAMENTE grande, por isso, sendo apenas aplicado para partículas atômicas e subatômicas.
Por fim, a constante de Avogadro (NA), representada pela unidade mol, é uma das 7 unidades básicas do Sistema Internacional de Unidades (SI), utilizada para definir quantidade de matéria, sendo amplamente utilizada na química e na física.
Com os avanços tecnológicos novas casas decimais da constante de Avogadro vão sendo determinadas ao longo dos anos, a última atualização deste número ocorreu em 20 de maio de 2019, sendo considerado como oficial atualmente o valor de 6,022 14076 x 1023.
Com a determinação deste valor, pode-se determinar outros valores previstos previamente por Avogadro, como o volume molar de uma substância.
Avogadro havia atribuído o nome de Volume Molar (Vm) ao volume ocupado por um mol de quaisquer gás nas condições normais de temperatura e pressão (25ºC e 1 atm). Com a determinação da Constante de Avogadro determinou-se o valor do volume molar, que é de: 22,4L/mol.
Desta forma, conclui-se que 22,4 litros de quaisquer gás nas condições normais de temperatura e pressão (25ºC e 1 atm) possuem 6,02×1023 moléculas.
Uma das contribuições mais significativas do Princípio de Avogadro é que a constante dos gases apresenta o mesmo valor para todos os gases, uma vez que em uma transformação gasosa o número de mols não sofre alteração.
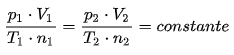
Onde,
p = pressão (em atm)
T = temperatura (em Kelvin)
V = volume (em litros)
n = número de mols
Essa constante mais tarde seria chamada de Constante Universal dos Gases, com valor de 0,082 atm.L/mol.K e faria parte da Equação Geral dos Gases: PV = nRT.
Leia mais:
Teoria Cinética Molecular e o Estudo dos Gases
Exercícios sobre a teoria cinética dos gases
Gás Nobre, nesse post vimos que o conhecimento é uma construção realizada por vários cientistas, apesar de o título ser Princípio de Avogadro, vimos que este cientista infelizmente não conseguiu determinar o número que recebe seu nome.
No entanto, vimos que em reconhecimento ao seu trabalho, o número de mol (6,02×1023) recebeu o nome de Constante de Avogadro e vimos também, que a hipótese levantada por este cientista lá em 1811 teve influência em diversos estudos relacionados aos gases, ajudando na elaboração de algumas das Leis dos Gases.
Leia mais em: Número de Mol e Massa Molar
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda nesse ano.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


