Fala Gás Nobre, hoje vamos resolver alguns exercícios sobre Teorias Ácido-Base. Essas teorias buscam explicar o comportamento de ácidos e bases se baseando em alguma característica principal destas substâncias.
Mas antes dos exercícios, vamos fazer uma breve revisão sobre 3 destas teorias.
Teoria Ácido-Base de Arrhenius (1887)
O físico-químico sueco Svante August Arrhenius através de experimentos que testavam a condutividade elétrica em soluções verificou que determinadas substâncias químicas sofrem ionização (formam íons em meio aquoso) ou dissociação iônica (íons são separados pela ação da água) e devido a isso, conduziam corrente elétrica.
Ao analisar os íons formados por estas substâncias, ele notou que algumas produziam o mesmo tipo de cátion e outras produziam o mesmo tipo de ânion e que devido a isso, possuíam propriedades muito semelhantes, podendo pertencer a um mesmo grupo de substâncias.
Deste modo, Arrhenius definiu seu conceito de ácidos e de bases, sendo:
Ácido: É toda substância que em água produz como cátion somente H3O+
Base: É toda substância que em água produz como ânion somente OH–.
Os ácidos e bases de Arrhenius seguem as reações genéricas abaixo:
HA + H2O H3O+ + A–
BOH + H2O B+ + OH–
Outra observação foi que a reação de neutralização entre esses compostos formava como produto sal e água.
HA + BOH BA + H2O
No entanto, apesar de explicar de forma concisa o conceito de ácido e base, essa teoria apresentava inúmeras limitações, por estar restrita a soluções aquosas.
Leia mais em:
Aula: Funções Inorgânicas – Ácidos
Aula – Funções Inorgânicas – Bases
Teoria de Brønsted-Lowry
Também conhecida com teoria protônica, foi elaborada em 1923 de maneira independente pelo químico dinamarquês Johannes Brønsted e pelo químico inglês Thomas Lowry. Ela se baseia na transferência de prótons (íons H+) entre ácidos e bases.
Essa teoria define:
Ácido: É toda espécie química capaz de doar um próton (doadora)
Base: É toda espécie química capaz de receber um próton (receptora)
Isso significa que uma substância só atua como ácido de Bronsted-Lowry na presença de uma base de Bronsted-Lowry e vice-versa. A substância doadora só irá doar o próton na presença de uma substância receptora. Por isso observa-se a formação de pares conjugados de ácido-base de Bronsted.
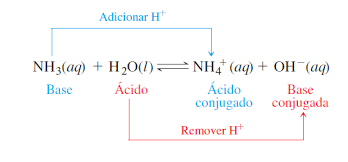
Essa teoria é mais abrangente que a teoria de Arrhenius, pois define outras substâncias como ácidos e bases além dos definidos pela teoria de Arrhenius, no entanto, ainda apresenta limitações por apenas abranger substâncias que liberam e recebem o próton H+.
Leia mais em:
Ácidos: Definição e Classificação
Bases: Definição e Classificação
Teoria de Lewis
Também conhecida como teoria eletrônica, essa teoria foi desenvolvida em 1923 pelo físico-químico estadunidense Gilbert Newton Lewis. Que define ácidos e bases da seguinte maneira:
Ácido: É toda espécie química que recebe um par de elétrons (e– receptora)
Base: É toda espécie química que doa um par de elétrons (e– doadora)
Exemplo de Reação:
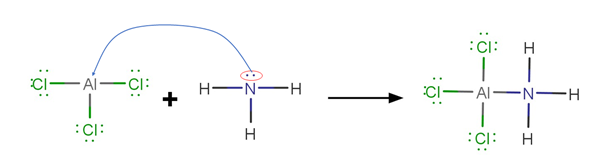
Observe que o cloreto de alumínio (ácido) recebe o par de elétrons que a amônia possui (base).
Leia mais em:
Ácidos: Força ácida
Qual é o ácido mais forte do mundo?
Pronto Gás Nobre, agora que já estamos feras em teorias ácido-base, vamos ver como resolver alguns exercícios desse assunto.
Exercícios
01 – (FGV) A água participa em reações com diversas espécies químicas, o que faz com que ela seja empregada como solvente e reagente; além disso, ela toma parte em muitos processos, formando espécies intermediárias e mais reativas.
I. HNO2 + H2O NO2– + H3O+
II. NH3 + H2O NH4+ + OH–
III. O2- + H2O OH– + OH–
De acordo com a teoria de ácidos e bases de Brönsted-Lowry, a classificação correta da água nas equações, I, II e III é, respectivamente:
a) base, base e ácido. c) base, ácido e base. e) ácido, base e base.
b) base, ácido e ácido. d) ácido, base e ácido.
Resolução:
De acordo com Brönsted-Lowry, ácidos são substâncias químicas doadoras de prótons (íon H+) e bases são as receptoras.
Na letra A, podemos observar que a água está recebendo o íon H+ do HNO2, formando o íon H3O+, ou seja, neste caso, água está se comportando como uma base.
Na letra B, a água está doando um próton (H+) para a amônia, formando o íon hidroxila (OH–), ou seja, ao doar o próton H+, a água está se comportando como um ácido.
Na letra C, a água também está doando um próton (H+) para o O2-, ou seja, neste caso, a água também está se comportando como um ácido.
Resposta: b) base, ácido e ácido.
02 – (UDESC) Em relação à equação mostrada abaixo, assinale a alternativa que contém a classificação da função inorgânica de cada espécie e de seus pares conjugados.
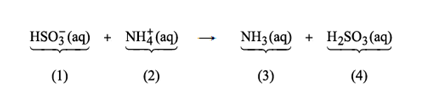
a) 1 é base, 2 é ácido e 3 e 4 são sais.
b) 1 e 3 são ácidos, 2 e 4 são bases.
c) 1 e 4 são ácidos, 2 e 3 são bases.
d) 1 é acido, 2 é base e 3 e 4 são sais.
e) 1 e 3 são bases, 2 e 4 são ácidos.
Resolução:
A teoria ácido base que abrange o conceito de pares conjugados é a teoria de Brönsted-Lowry. De acordo com esta teoria, ácidos são substâncias químicas doadoras de prótons (íon H+) e bases são as receptoras.
O íon HSO3– recebe um próton H+ formando o ácido sulfuroso (H2SO3), ou seja, o íon HSO3– trata-se da base e o ácido formado é o seu ácido conjugado. Já o íon NH4+ doa um próton formando a amônia (NH3), isto é, o íon NH4+ comporta-se como ácido e a amônia é sua base conjugada.
Temos que:
1 – HSO3– – base
2 – NH4+ – ácido
3 – NH3 – base conjugada
4 – H2SO3 – ácido conjugado
Resposta: e) 1 e 3 são bases, 2 e 4 são ácidos
03 – (FMPA-MG) De acordo com o critério de Lewis de acidez e basicidade, as espécies abaixo podem ser classificadas como:
I . AlCl3 II. H2O III. NH3 IV. CH4
a) I – ácido; II – ácido; III – base; IV – ácido
b) I – ácido; II – base; III – base; IV – nem ácido, nem base
c) I – ácido; II – base; III – base; IV – ácido
d) I – base; II – ácido; III – base; IV – nem ácido, nem base
e) I – nem ácido, nem base; II – base; III ácido
Resolução:
Segundo Lewis, ácidos são espécies capazes de receberem pares eletrônicos e bases são as espécies doadoras desses pares, portanto, vamos analisar cada uma das espécies
I. AlCl3: Espécie capaz de receber um par de elétrons, portanto, trata-se de um ácido de Lewis.
II. H2O: O oxigênio presente na molécula de água possui pares eletrônicos, podendo doá-los, ou seja, trata-se de uma base de Lewis.
III. NH3: O nitrogênio presente na amônia, assim como o oxigênio na água, possui par de elétrons que pode doar, ou seja, também trata-se de uma base de Lewis.
IV. CH4: O metano trata-se de uma molécula pouco reativa que não possui pares de elétrons em seu átomo central (C), ou seja, não se trata nem de uma base, nem de um ácido de Lewis.
Resposta: b) I – ácido; II – base; III – base; IV – nem ácido, nem bas
04 – (UEM) Considere as reações
I. BF3(l) + F–(aq) BF4–(aq)
II. Ag+(aq) + 2CN–(aq) Ag(CN)2–(aq)
III. NH3(g) + HCl(g) NH4Cl(g)
É correto afirmar que:
a) o NH3(g) é uma base segundo Arrhenius.
b) o Ag+ é ácido segundo Lewis.
c) o CN– é um ácido segundo Brönsted-Lowry.
d) o BF3 é uma base segundo Lewis.
e) o HCl é uma base segundo Brönsted-Lowry.
Resolução:
Vamos analisar cada uma das alternativas:
a) o NH3(g) é uma base segundo Arrhenius.
Errado. Segundo Arrhenius bases são substâncias que liberam como ânion apenas o íon OH– em meio aquoso, mas é uma base segundo Brönsted-Lowry por receber prótons e segundo Lewis por doar seu par de elétrons.
b) o Ag+ é ácido segundo Lewis.
Correto. Segundo Lewis ácido é toda substância que recebe um par de elétrons, e na reação acima o íon Ag+ recebe o par de elétrons do íon CN–.
c) o CN– é um ácido segundo Brönsted-Lowry.
Errado. CN– doou um par de elétrons par ao Ag+, portanto, trata-se de uma base de Lewis.
d) o BF3 é uma base segundo Lewis.
Errado. Pois o BF3 recebeu um par de elétrons do F– e segundo Lewis, bases são doadoras de pares eletrônicos e não receptoras.
e) o HCl é uma base segundo Brönsted-Lowry.
Errado. O HCl doou um próton para a água e segundo Brönsted, bases são receptoras de prótons e não doadoras.
Resposta: b) o Ag+ é ácido segundo Lewis.
Gás Nobre, quer saber mais sobre o assunto de ácidos e bases e como ele é cobrado em questões no ENEM? Dá uma conferida neste post que eu fiz aqui no nosso blog.
Leia mais em:
Chuva Ácida
Chuva ácida: Uma explicação química
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


