Fala Gás Nobre, hoje vamos falar sobre os tipos de entalpia, que é a energia presente em um determinado sistema e a classificação das reações químicas.
Existem diversos tipos de reações químicas e estas podem ser classificadas de acordo com algumas de suas características.
Existe mais de um tipo de classificação, seguindo características específicas, como por exemplo:
– Reversibilidade: A reação é classificada como reversível ou irreversível, de acordo com a possibilidade dos produtos serem convertidos a reagentes novamente ou não.
Uma reação reversível é representa com dupla seta () enquanto a irreversível com seta apenas no sentido da formação dos produtos (→).
Leia mais em: Reações Irreversíveis e Reversíveis
As reações ainda podem ser divididas em outros 4 tipos:
– Síntese: A + B → AB
Onde 2 ou mais reagentes reagem para formar 1 único produto.
– Decomposição: AB → A + B
Onde 1 único reagente forma 2 ou mais produtos.
– Simples troca: A + BC → AB + C
Uma substância simples reage com uma substância composta, originando uma nova substância simples e uma nova substância composta.
– Dupla troca: AB + CD → AD + CB
Duas substâncias compostas reagem, misturando entre si dois elementos e formando duas novas substâncias compostas.
Leia mais em:
Classificação das Reações Inorgânicas
Reações Inorgânicas: 6 dicas para resolver exercícios
E existe outro tipo de classificação das reações que são definidos a partir da entalpia, que é a energia, na forma de calor, envolvida nestes processos. Mas antes de falar deste tipo de classificação, falaremos sobre o que é a tal da Entalpia.
A entalpia é a quantidade de energia envolvida em uma determinada reação ou sistema químico. Essa energia pode ser absorvida ou liberada, sendo o tipo de processo classificado a partir desta liberação ou absorção de energia.
Chama-se de Processo Endotérmico quando a reação absorve energia e de Processo Exotérmico quando há liberação de energia.
A entalpia de um processo químico (ou físico) pode ser determinada a partir de cálculos utilizando-se de equações químicas e dados experimentais.
A classificação (exo e endotérmica) e a medida da quantidade de energia envolvida no processo, podem ser realizados através da seguinte relação:
∆H = HP – HR
Onde,
∆H → Variação de entalpia
HP → Entalpia dos produtos
HR → Entalpia dos reagentes
Ou seja, é dada pela diferença de energia dos produtos (final) e dos reagentes (inicial), se o valor de ∆H < 0, significa que a energia dos reagentes é maior do que os produtos e portanto, o processo é exotérmico, pois libera energia no final. Mas se o valor de ∆H > 0, significa que a energia dos produtos é maior e que houve absorção de energia, sendo assim classificado como endotérmico.
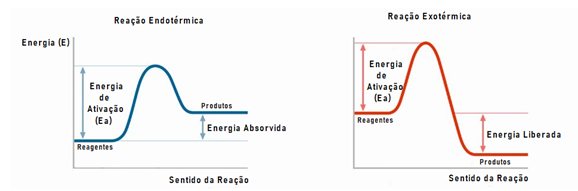
Cada composto químico apresenta características próprias, ou seja, o tipo de substância determina o tipo de entalpia a ser calculado. Além do próprio processo envolvido na reação, que gera dados experimentais específicos para cada tipo, como abordaremos mais para frente.
Existem 5 tipos de entalpia, que veremos a seguir:
– Entalpia de Formação
Mede o calor absorvido ou liberado na formação de 1 mol de uma substância a partir da reação entre seus elementos constituintes, ou seja, na forma de substâncias simples ou elementares.
Sendo representada por ∆Hf, onde o ‘f’ significa ‘formação’.
Por exemplo, a reação de formação da água é dada pela reação entre o gás hidrogênio (H2) e o gás oxigênio (O2), sendo a entalpia de formação da água, a energia envolvida nesta reação.
H2(g) + ½ O2(g) → H2O(l)
∆H = HP – HR
∆H = -286 kJ/mol (dado experimental e tabelado)
É importante ressaltar que substâncias simples, na forma alotrópica mais estável, possuem calor de formação igual a 0. Pois, uma vez que classificamos uma reação como de formação sendo a reação a partir de substâncias simples, não há como medir a entalpia de formação destas substâncias simples, considerando-se assim, igual a 0.
– Entalpia de Combustão
Mede a energia envolvida na queima de 1 mol de uma substância no estado padrão na presença de oxigênio. Reações de combustão, por envolverem queima, são todas exotérmicas, ou seja, liberam energia, possuindo assim, ∆H < 0.
Pode ser representada como ∆HC, onde o ‘c’ representa combustão.
Os exemplos mais comuns de reações de combustão são as que envolvem moléculas orgânicas, como hidrocarbonetos. Uma reação de combustão comum no dia a dia está presente nos motores de automóveis movidos a gasolina (octano, C8H18) ou no gás de cozinha (butano, C4H10). A queima destes combustíveis resulta na formação de CO2 e H2O, conforme reação a seguir:
C4H10(g) + 13/2 O2(g) → 4 CO2(g) + 5 H2O(g) ∆H = -2878 kJ/mol
C8H18(g) + 25/2 O2(g) → 8 CO2(g) + 9 H2O(g) ∆H = -5471 kJ/mol

Leia mais em:
Reações com Compostos Orgânicos
7 Reações Químicas que você não pode perder
– Entalpia de Neutralização
Mede a energia envolvida na reação entre 1 mol de íons H3O+ e 1 mol de íons OH–, ou seja, na reação entre um ácido e uma base, tornando o pH neutro, por isso o nome de ‘Neutralização’.
Pode ser representada por ∆HN, onde ‘n’ representa neutralização.
O exemplo mais comum é da reação entre o ácido clorídrico (HCl) e o hidróxido de sódio (NaOH) formando cloreto de sódio (NaCl)(sal de cozinha) mais água.
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
– Entalpia de Dissolução
Mede a energia envolvida na quebra dos retículos cristalinos do soluto e na hidratação dos mesmos. Isto é, a energia envolvida quando se é dissolvido um soluto em um solvente, neste caso a água.
O processo de dissolução envolve 2 processos de variação de energia, o de energia reticular, onde as moléculas do estado sólido saem do estado de agregação reticular (entalpia reticular) e são então solvatadas pela água (entalpia de hidratação).
– Entalpia de Mudança de Estado Físico
Mede a energia envolvida num processo físico e não químico, pois não há reação química envolvida, ou seja, não há formação de novos produtos, apenas mudança de estado físico.
Este tipo de entalpia mede a energia necessária (liberada ou absorvida) para que 1 mol de uma substância, nas condições normais de temperatura e pressão, mude de estado físico.
Dentro deste tipo de entalpia, temos:
– Entalpia de Vaporização: Energia envolvida na mudança do estado líquido para gasoso.
– Entalpia de Fusão: Energia envolvida na mudança do estado sólido para o líquido.
– Entalpia de Solidificação: Energia envolvida na mudança do estado líquido para o sólido.
– Entalpia de Liquefação: Energia envolvida na mudança do estado gasoso para o líquido.
– Entalpia de Sublimação: Energia envolvida na mudança do estado gasoso para o sólido e vice-versa.
Leia mais em: Mudanças de Estado Físico da Matéria
E agora que estamos feras em entalpia, sabemos que as reações químicas ainda podem ser classificadas como exotérmicas, quando liberam calor e endotérmicas, quando absorvem calor.
A entalpia ainda é muito importante para, juntamente com a entropia (assunto que fica para um próximo texto), determinarmos a Energia Livre de Gibbs e consequentemente, se a reação é espontânea ou não.
Leia mais em: Energia Livre de Gibbs
E aí Gás Nobre, gostou desse assunto? Ficou curioso pra saber mais? Então fique por dentro de nossas redes sociais, Canal no Youtube e aqui no nosso blog. Reage!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


