Gás Nobre, neste post vamos falar sobre os tipos de Isomeria: plana e espacial. Mas, antes, vamos relembrar um pouco esse conceito.
A Isomeria começou a ser estudada em 1823, quando os químicos Liebig e Wohler criaram, respectivamente o isocianato de prata (AgCNO) e o cianato de prata (AgNCO). A Isomeria foi comprovada quando Wohler conseguiu sintetizar a uréia a partir do sal cianato de amônio, obtido a partir da amônia:
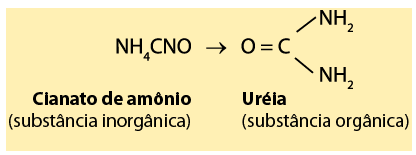
Com isso, Wohler percebeu que tanto o cianato de amônio quanto a ureia tinham os mesmos constituintes químicos. Em outras palavras a mesma fórmula molecular. A partir daí, definiu-se isomeria como: “Isomeria é um fenômeno em que dois ou mais compostos químicos com propriedades diferentes apresentam a mesma fórmula molecular e fórmulas estruturais diferentes.”
A isomeria é dividida em duas partes: Isomeria plana ou constitucional e a Isomeria espacial ou estereoisomeria. Por sua vez, elas são divididas em subgrupos, que veremos a seguir.
Isomeria Plana
Na isomeria plana ou isomeria constitucional, é o caso de isomeria em que os isômeros podem ser diferenciados pelas suas fórmulas estruturais planas. Os compostos que apresentam essa características são chamados de isômeros planos.
Isomeria de cadeia
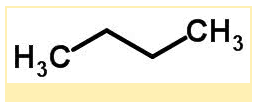
A Isomeria de cadeia ocorre quando os átomos de carbono apresentam cadeias diferentes e a mesma função química. Exemplo:
Estrutura molecular do butano (C₄H₁₀):
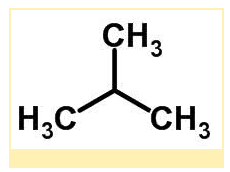
Estrutura molecular do metilpropano (C₄H₁₀):
Leia mais: O que é Radiação Nuclear?
Isomeria de compensação
É um tipo de isomeria em que em que os isômeros pertencem a mesma função, têm o mesmo tipo de cadeia, mas se diferenciam na posição relativa do heteroátomo. Um exemplo são as estruturas moleculares do Metoxipropano e do Etoxietano (C₄H₁₀O)
Metoxipropano: H₃C – O – CH₂ – CH₂ – CH₃ (heteroátomo está entre os carbonos 1 e 2)
Etoxietano: H₃C – CH₂ – O – CH₂ – CH₃ (heteroátomo está entre os carbonos 2 e 3)
Isomeria de função
Aqui, a diferença entre os isômeros está no grupo funcional. Um exemplo é a fórmula molecular C₂H₆O, em que um isômero (metoximetano) é do grupo dos éteres, já o outro (etanol) é do grupo dos álcoois.
Metoximetano: H₃C – O – CH₃
Etanol: H₃C – CH₂ – OH
Leia mais: Eletroquímica: Resumos e Exercícios
Isomeria de posição
Na Isomeria plana de posição, os isômeros pertencem à mesma função, têm a mesma característica de cadeia, mas são diferentes quanto à posição de algum substituinte (grupo funcional, insaturação e ramificação). Um exemplo:
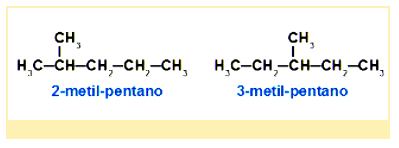
Tautomeria
A tautomeria ou isomeria dinâmica é vista como um caso específico de isomeria de função. O que acontece é que, neste caso, um isômero pode transformar-se em outro pela alteração na posição de um elemento na cadeia. Veja o exemplo:
Estrutura molecular de etanal C₂H₄O:
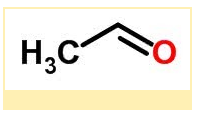
Estrutura molecular de etenol C₂H₄O:
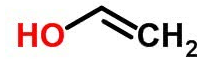
Esse tipo de isomeria pode apresentar um equilíbrio entre os seus isômeros, nos quais são denominados equilíbrios aldo-enólico (entre um aldeído e um enol) e ceto-enólico (entre uma cetona e um enol) como o exemplo abaixo:
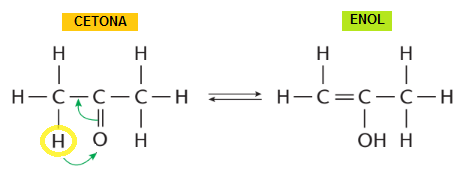
Leia mais: pH: Tudo o Que Você Precisa Saber e Mais um Pouco
Isomeria Espacial
No caso da Isomeria espacial, a diferença entre os isômeros só pode ser vista por meio da orientação de seus átomos no espaço.
Isomeria geométrica
Na Isomeria geométrica ou cis-trans, a diferença é que no isômero denominado como cis, os ligantes estão do mesmo lado da dupla ligação ou em compostos cíclicos, no mesmo lado do plano. Já os ligantes do isômero trans estão em lados opostos. Veja o exemplo abaixo:
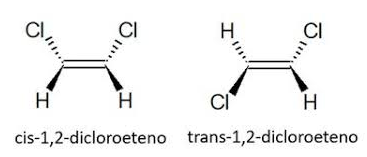
Fórmula molecular C₂H₂Cl₂
Isomeria óptica
É a Isomeria que ocorre quando a substância consegue desviar um feixe de luz polarizada. Se desviar para a direita, será chamado de isômero dextrogiro; se desviar para a esquerda, será um isômero levogiro.
Esses isômeros são chamados de enantiômeros e são a imagem especular um do outro, mas não são sobreponíveis. Um clássico exemplo de enantiômeros são os isômeros R/S da talidomida:
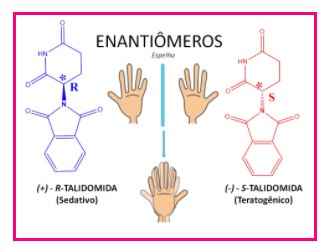
Ambos apresentam a mesma fórmula molecular e são a imagem especular um do outro, no entanto, enquanto o isômero R é utilizado como medicamento sedativo e eficaz contra enjoos, o isômero S apresenta efeitos teratogênicos, ou seja, pode causar má formação de fetos se consumido por mulheres durante a gestação.
Leia mais:
Gás Nobre, espero que este post tenha ajudado você a entender os diferentes tipos de isomeria plana e espacial. E se você quiser um auxílio no seu processo de estudo, venha estudar com a gente e realize seu sonho de cursar uma faculdade!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


