Gás Nobre, já imaginou um guia completo, contendo um super resumo e orientações sobre o estudo das moléculas? Pois bem, saiba que é exatamente o objetivo deste artigo!
Então, se você quer mandar bem nesse tema, leia até o final do artigo, pois separei 7 dicas preciosas, indo do início ao fim, para que você possa mandar bem nesse assunto. A dica de número 7 é muito especial… Tenho certeza que você vai gostar!
Então bora reagir?
Passo 1: Saiba Como Identificar o Número de Elétrons da Camada de Valência
Identificar o número de elétrons na camada de valência é essencial para compreendermos como vão funcionar as ligações químicas, que são interações interatômicas. Para isso, vou utilizar como exemplo três elementos químicos: hidrogênio, oxigênio e cloro.
O número de elétrons presentes na camada de valência pode ser achado através da tabela periódica ou através da distribuição eletrônica, utilizando o diagrama de Linus Pauling.
Com a tabela periódica, basta olharmos o número da família ou grupo (referencial na vertical) em que o elemento analisado está contido. Nos exemplos que escolhemos, observe logo abaixo um trecho da tabela, adaptado para que você possa entender onde quero chegar:
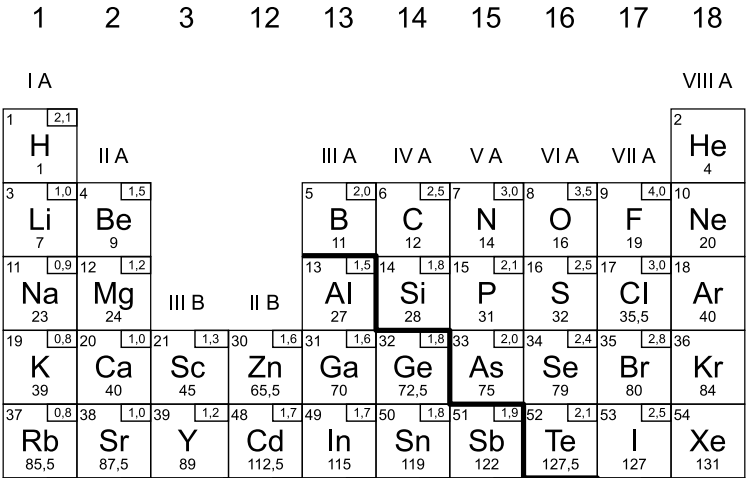
Observe que o hidrogênio está localizado na família IA (grupo 1), enquanto o oxigênio está na família VIA (grupo 16) e o cloro na família VIIA (grupo 17). Como o número da família nos indica o número de elétrons da camada de valência, temos que o hidrogênio tem 1 elétron, o oxigênio 6 e o cloro 7. Fácil, não é?
Mas e se a tabela periódica não estiver presente?
Para isso, basta utilizarmos do número atômico e fazer a distribuição eletrônica utilizando o diagrama de Linus Pauling. Observe como fica, e repare na configuração eletrônica da camada de valência (destacado em negrito):
1H: 1s1
8O: 1s2 2s2 2p4
17Cl: 1s2 2s2 2p6 3s2 3p5
Passo 2: Lembre-se da Regra do Octeto
A Regra do Octeto é muito importante para conseguirmos identificar o tipo de ligação química, bem como saber como estabelecer as ligações covalentes em uma molécula, visando alcançar a estabilidade dos átomos.
Essa regra diz que, para um átomo se tornar estável, ele precisa alcançar a quantidade de 8 elétrons em sua camada de valência. E como toda regra, há exceções! O hidrogênio é um caso importante para você se lembrar: ele se estabiliza com 2 elétrons na camada de valência, seguindo o que chamamos de “regra do dueto”.
Passo 3: Identificando o Tipo de Ligação Química
O estudo das moléculas, é o estudo dos casos em que o tipo de ligação química que ocorre entre os átomos, vem ser a ligação covalente.
Mas como identificar o tipo de ligação química?
De uma forma geral, as ligações iônicas ocorrem entre metais e ametais, como por exemplo no cloreto de sódio (NaCl). As ligações metálicas ocorrem entre metais, como por exemplo, uma barra de ferro (Fe). As ligações covalentes ocorrem entre ametais, hidrogênios ou hidrogênio e ametais, como por exemplo, a água (H2O), hidrogênio molecular (H2) ou oxigênio molecular (O2).
Lembre-se que sempre há exceções, mas esse caminho pode lhe ajudar a direcionar os seus estudos.
Ah, e antes que eu me esqueça: o nosso foco são nas moléculas, ou seja, estamos focados na ligação covalente.
Passo 4: Estabelecendo as Ligações Químicas
A ligação covalente é caracterizada por ser um compartilhamento de elétrons entre os átomos. Você precisa saber estabelecer o número correto de ligações que ocorrem entre os átomos de uma molécula.
No caso do oxigênio molecular (O2), sabemos que cada átomo de oxigênio possui 6 elétrons na camada de valência. Isso quer dizer, que para chegar aos oito elétrons na última camada, cada oxigênio precisará fazer 2 ligações covalentes. Como são dois átomos de oxigênio, teremos a seguinte representação: O = O; onde a representação “=” significa que temos uma ligação covalente dupla entre os seus átomos.
Outro exemplo legal de se mencionar, seria o cloreto de hidrogênio (HCl). Sabendo que o hidrogênio precisa fazer 1 ligação covalente (pois se estabiliza com 2 elétrons), e o cloro também (pois tem 7 elétrons na camada de valência), teremos a representação: H – Cl; onde “-” representa uma ligação simples.
Passo 5: Lembre-se da Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência (TRPECV)
No momento de montar as estruturas, as moléculas que possuem mais de 2 átomos precisam levar em consideração o que diz a Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência (TRPECV). Essa teoria nos diz que, quando um átomo que não está na extremidade da molécula, apresenta pelo menos 1 par de elétrons “sobrando”, teremos uma repulsão das ligações químicas estabelecidas.
Nesse sentido, observe como seria a representação da estrutura da molécula de água (H2O):
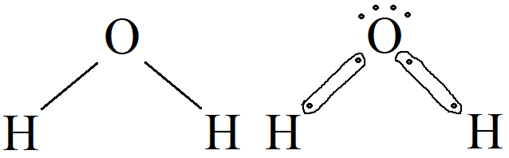
Esse é um simples (e importante!) exemplo da importância dessa teoria. Muitos representariam a sua estrutura como: H – O – H; mas essa forma, ainda que estivesse com todos os seus átomos estabilizados, não estaria correta justamente pelo fato da repulsão existente.
Passo 6: Saiba Identificar as Geometrias Moleculares
Existem diversos tipos de geometrias moleculares. As principais, e mais abordadas, são: geometria linear, angular, piramidal, triangular/trigonal plana e tetraédrica.
A dica que lhe dou, para identificar o tipo correto de geometria molecular, é: saiba como montar corretamente a estrutura de uma molécula!
Ainda usando a água como exemplo, uma montagem errada faria com que tivéssemos a geometria do tipo linear, porém, tendo em vista a repulsão das ligações por causa dos 2 pares de elétrons do oxigênio que não participam das ligações, a geometria molecular correta seria a do tipo angular.
Percebeu a importância de uma montagem correta das estruturas?
Passo 7: Uma Dica Preciosa
Gás Nobre, a dica preciosa, e que organizei com muito carinho para você estudar no conforto da sua casa como se fosse presencialmente comigo, são aulas e outros artigo do blog para você se aprofundar nesse tema. Já está tudo organizadinho, basta acessar os links 😀
Aula 1:
Aula 2: Fórmula estrutural
Aula 3: Geometria molecular
Artigo 1: Ligações covalentes no nosso cotidiano
Artigo 2: Ligações covalentes no nosso cotidiano parte 2
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.



Muito útil!