Fala Gás Nobre, hoje falaremos sobre o que é e para que serve uma solução tampão. Você sabe o que é? Já ouviu falar sobre? Não? Então bora reagir!
Solução tampão é uma solução capaz de manter o pH estável, isto é, sem sofrer variação, mesmo após a adição de pequenas quantidades de um ácido ou de uma base. A ação dessas soluções é chamada de efeito tampão.
Mas o que é uma solução?
Solução é uma mistura homogênea, ou seja, apresenta uma única fase, de 2 ou mais substâncias, sendo a substância dissolvida chamada de soluto e a que dissolve a outra de solvente. Podem-se encontrar soluções em todos os estados da matéria: sólido, líquido e gasoso.
Leia mais em:
Introdução ao Estudo das Soluções
Soluções: O que você precisa saber?
Soluções: Coeficiente de Solubilidade (CS) e Classificação das Soluções
As soluções podem ser compostas por moléculas ou íons. A concentração destas partículas presentes na solução pode ser determinada através de algumas fórmulas químicas.
Podemos determinar a concentração comum, que é relação de massa, em gramas, por volume em litros.
C(g/L) = m (g) / V (L)
E podemos determinar a concentração molar, que é a relação da quantidade de matéria, em mols, por volume em litros.
M (mol/L) = n (mols) / V (L)
Leia mais em:
Concentração das Soluções (I)
Concentração das Soluções (II)
Algumas soluções apresentam uma propriedade chamada de efeito tampão, que é a estabilização dos valores de pH da solução numa pequena faixa, que sofre pequenas variações (ao invés de grandes variações) mesmo após adição de determinada quantidade de um ácido ou uma base.
Mas o que é pH? Tá lembrado?
O pH ou potencial hidrogeniônico, mede a quantidade de íons H+ (ou H3O+) que estão dispersos em uma solução. O pH apresenta valores numa escala que varia de 0 a 14 (na temperatura de 25°C), sendo o 7, seu valor mediano, considerado como pH neutro. Valores de pH abaixo de 7 são considerados ácidos e acima de 7, básicos.
Uma medida que se complementa ao pH é o pOH, que mede a quantidade de íons OH- presente na solução. O pOH é o inverso do pH, ou seja, valores de pOH abaixo de 7 indicaram que a solução é básica e valores acima de 7, que a solução é ácida. A soma entre pOH e pH de uma solução será sempre igual a 14.
pH + pOH = 14

Veja mais sobre na nossa videoaula sobre pH e pOH.
De modo geral, as soluções sofrem variações do valor de pH após adição de substâncias ácidas ou básicas. No entanto, algumas destas soluções mantém-se estáveis mesmo após a adição de compostos ácidos ou básicos e a estas soluções chamados de “Solução Tampão”.
Existem 2 tipos de Solução-Tampão:
I – Formada pela mistura de um ácido fraco com sua base conjugada;
II – Formada pela mistura de uma base fraca com seu ácido conjugado.
Primeiro, temos que lembrar o que significa base e ácido conjugado.
De acordo com a Teoria Ácido-Base de Brönsted-Lowry, todo ácido e toda base terão um par, que será respectivamente, sua base e seu ácido conjugados.
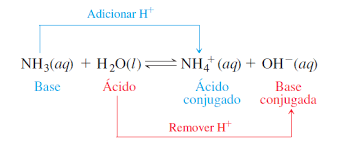
Por exemplo, na reação acima temos uma base (NH3) e um ácido (H2O) de Brönsted-Lowry e seus respectivos ácido (NH4+) e base (OH–) conjugadas.
Leia mais em:
Ácidos e Bases no ENEM
Teorias Ácido-Base: Exercícios Resolvidos
Vamos então falar dos 2 tipos de soluções tampão e o que acontece quando adicionamos pequenas quantidade de um ácido ou uma base forte.
I – Solução Tampão: Ácido Fraco e sua Base Conjugada.
Obtém-se esse tipo de solução ao misturar-se um ácido fraco com um sal do mesmo ânion desse ácido.
Por exemplo, uma solução tampão pode ser obtida a partir da mistura do ácido acético (CH3COOH), presente no vinagre, com o acetato de sódio (CH3COONa), pois ambos têm em comum o ânion acetato (CH3COO–). O ácido acético é um ácido fraco, ou seja, apresenta baixa constante de ionização, enquanto o sal apresenta uma alta constante de dissociação. Desta forma, os íons de acetato presentes na solução, são em sua maioria, oriundos do sal, de acordo com as reações abaixo:
CH3COONa(aq) ⇄ Na+(aq) + CH3COO–(aq)
CH3COOH(aq) + H2O(l) ⇄ CH3COO–(aq) + H3O+
Vamos ver o que acontece com este tipo de solução quando:
– Realizamos adição de uma pequena quantidade de ácido forte:
A adição de um ácido forte aumenta a quantidade de íons H3O+ presentes na solução. Este excesso de íons H3O+ deslocam o equilíbrio da reação, fazendo com que os íons acetato (CH3COO–) voltem a sua forma ácida (CH3COOH).
CH3COO–(aq) + H3O+ ⇄ CH3COOH(aq) + H2O(l)
Leia mais em: Deslocamento de Equilíbrio Químico
Numa solução simples de ácido acético, esse acetato seria consumido rapidamente e o excesso de H3O+ iria diminuir o pH da solução. No entanto, devido a presença dos íons acetato do acetato de sódio (CH3COONa), o excesso de íons H3O+ irá reagir com estes íons formando mais ácido acético. Enquanto estes íons acetatos provenientes do sal não forem completamente consumidos, observamos variações muito pequenas no pH, chamado de efeito tampão. Após o consumo total, vamos observar a diminuição do pH da solução.
Leia mais em:
Aula: Funções Inorgânicas – Ácidos
Ácidos: Definição e Classificação
– Realizamos adição de uma pequena quantidade de base forte:
A adição de uma base forte aumenta a quantidade de íons OH– em solução. Esses íons, por sua vez, serão neutralizados pelos íons H3O+ provenientes da ionização do ácido acético.
OH– + H3O+ ⇄ H2O(l)
Com esse consumo de íons H3O+, o equilíbrio é deslocado para reação de ionização do ácido acético e formação de mais H3O+, ou seja, a concentração desses íons será praticamente constante até que se esgote todo o ácido acético presente na solução.
CH3COOH(aq) + H2O(l) ⇄ CH3COO–(aq) + H3O+
De maneira semelhante, vamos manter o pH constante até a adição de determinada quantidade de base. Quando a capacidade limite do efeito tampão for atingida, observaremos um aumento no valor do pH da solução.
Leia mais em:
Aula: Funções Inorgânicas – Bases
Bases: Definição e Classificação
II – Solução Tampão: Base fraca e seu Ácido Conjugado
Obtém-se esse tipo de solução ao misturar-se uma base fraca com um sal do mesmo cátion dessa base.
Por exemplo, uma solução tampão pode ser obtida a partir da mistura entre a base hidróxido de amônio (NH4OH) e sal cloreto de amônio (NH4Cl), pois ambos possuem em comum o cátion amônio (NH4+).
Como citado no exemplo anterior, o sal apresenta uma alta constante de dissociação e se dissocia completamente em íons Cl- e NH4+, enquanto o hidróxido de amônio, por ser uma base fraca, apresenta baixo grau de dissociação. Contribuindo pouco para os íons presentes em solução.
NH4Cl(aq) ⇄ NH4+(aq) + Cl–(aq)
NH4OH(aq) ⇄ OH–(aq) + NH4+(aq)
Vamos ver o que acontece com este tipo de solução quando:
– Realizamos a adição de uma pequena quantidade de ácido forte:
Os íons H3O+ oriundos da adição do ácido serão neutralizados pelos íons OH– provenientes da dissociação da base (NH4Cl). Esse consumo desloca o equilíbrio para a dissociação da base e formação de mais íons OH-, fazendo com que a concentração desse íon permanece constante até que se esgote todo o hidróxido de amônio presente em solução.
NH4OH(aq) ⇄ OH–(aq) + NH4+(aq)
Desta forma, observaremos que o pH permanecerá constante até o completo consumo da base presente na solução. Após isso, uma diminuição do pH da solução será observado.
Leia mais em:
Ácidos: Força Ácida
Aula: Nomenclatura dos Ácidos
– Realizamos a adição de uma pequena quantidade de base forte:
A adição de uma base forte aumenta a quantidade de íons OH– presentes na solução. Este excesso de íons hidroxila desloca o equilíbrio da reação, fazendo com que os íons amônio (NH4+) voltem a sua forma básica (NH4OH).
Numa solução simples de hidróxido de amônio, esses íons NH4+ seriam consumidos rapidamente e o excesso de íons OH- iria aumentar o pH da solução. No entanto, devido a presença dos íons amônio do sal (NH4Cl), este excesso de íons OH- irá reagir com estes íons formando mais base (NH4OH).
Desta forma, enquanto estes íons provenientes do sal não forem completamente consumidos, observaremos variações muito pequenas do valor de pH da solução, chamado de efeito tampão. Após o consumo total, vamos observar uma elevação do valor do pH.
Por isso é importante que saibamos a concentração destes compostos em solução, para prevermos qual será a capacidade limite desta solução tampão.
Leia mais em:
Cálculo de Concentração de Soluções
Cálculo de Concentração de Soluções: Exercícios Resolvidos
Mas e qual a função prática deste tipo de solução?
Soluções Tampão são extremamente importantes quando temos um sistema em que não são desejáveis alterações no pH. Um exemplo é o nosso sangue, que possui uma faixa de pH ideal e que variações abaixo ou acima desta faixa apresentam sérios riscos a nossa saúde.
A faixa de pH ideal para o sangue é entre 7,35 e 7,45 e é mantida pela presença de uma solução tampão formada pelo ácido carbônico (H2CO3) e bicarbonato de sódio (NaHCO3), substâncias presentes no sangue.
Esse tipo de solução apresenta um papel extremamente importante na manutenção do pH, ajudando a manter o funcionamento de todo o sistema biológico, garantindo a sobrevivência, crescimento e reprodução das células de organismos vivos.
Certo Gás Nobre? Espero que tenha gostado de aprender sobre esse tipo especial de solução tão importante para nossas vidas.
Se quiser saber mais sobre esse e outros assuntos, fique sempre ligado nas nossas redes sociais e fique por dentro de diversos conteúdos exclusivos. Reage!
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


