Fala Gás Nobre, vamos falar hoje sobre as propriedades periódicas, que são as propriedades dos elementos químicos que variam periodicamente de acordo com os números atômicos e com sua posição na tabela periódica.
Aqui no blog já falamos bastante sobre a tabela periódica, seja sobre sua História, sobre sua Estrutura ou até mesmo como utilizá-la e interpretá-la. No entanto, hoje, falaremos sobre as propriedades periódicas e como elas variam ao longo da tabela, ou seja, você ficará ainda mais ninja em utilizar uma tabela periódica. Bora reagir?
Leia mais em:
A história da tabela periódica
A estrutura da tabela periódica
O que é a tabela periódica e como utilizá-la
Conforme citado anteriormente aqui no blog, a Tabela Periódica atual organiza os 118 elementos químicos até então conhecidos em uma ordem crescente de número atômico (Z – quantidade de prótons no núcleo do átomo).
Leia mais em: Novos elementos da tabela periódica
Muitas propriedades químicas e físicas dos elementos e das substâncias simples que eles formam variam periodicamente, ou seja, em intervalos regulares em função do aumento (ou da diminuição) dos números atômicos. As propriedades que se comportam dessa forma são chamadas de propriedades periódicas.
As principais propriedades periódicas químicas dos elementos são: raio atômico, energia de ionização, eletronegatividade, eletropositividade e eletroafinidade. Já as físicas são: pontos de fusão e ebulição, densidade e volume atômico.
No post anterior “Propriedades Periódicas – Parte I” falamos sobre as propriedades periódicas químicas. Já no post de hoje veremos de forma mais detalhada as propriedades periódicas físicas:
1- Massa Atômica
Hoje, pode-se dizer que é fácil determinar a massa de um átomo, com os equipamentos que temos a nossa disposição, mas, quando essa massa começou a ser necessitada, a realidade era bem diferente e que se tinha eram métodos comparativos. Com isso, se pegou o isótopo 12 do carbono, que contém 6 prótons e 6 nêutrons e definiu-se que uma unidade de massa atômica (u) seria igual a 1/12 da massa desse isótopo, que corresponde à 1,66 x 10-24 g.
Agora que já relembramos o que é uma unidade de massa atômica, vamos ver como calculamos a massa de um elemento químico. Para isso, temos que saber quais são seus isótopos (elementos com a mesma quantidade de prótons, mas diferentes quantidades de nêutrons) e a abundância desses. A massa de cada isótopo é dada pela soma dos prótons e nêutrons e então fazemos uma média ponderada dessas massas considerando a abundância dos isótopos. Quando pegamos, por exemplo, o nitrogênio, ele possui 7 prótons e isótopos com 7 nêutrons em abundância de 99,6% e com 8 nêutrons em abundância de 0,4%. O primeiro isótopo terá 14u, e o segundo, 15u. O resultado final será dado pela média ponderada desses, ou seja:
m = (14 x 0,996) + (15 x 0,004)
m = 13,944 + 0,06
m = 14,004u
Leia mais em:
Massa Atômica e Massa Molecular
Aula: Massa atômica, massa molecular, massa molar e mol
Não adianta muito para nós sabermos a massa em unidades de massa atômica, por isso, sempre relacionamos com um mol de elemento, aí teremos esse resultado em gramas.
Leia mais em: Mol e Massa Molar
Falamos que a massa é o somatório dos prótons e nêutrons, mas e os elétrons? Para o cálculo, nós podemos desconsiderar a contribuição do elétron, pois essa é muito pequena e no resultado final não faria diferença.
Para fins de compreensão:
– Massa do próton: 1,673 x 10-24g
– Massa do nêutron: 1,675 x 10-24g
– Massa do elétron: 9,109 x 10-28g
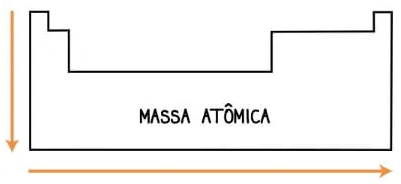
O crescimento da massa atômica dos elementos na tabela é da esquerda para a direita e de cima para baixo.
2. Volume Atômico
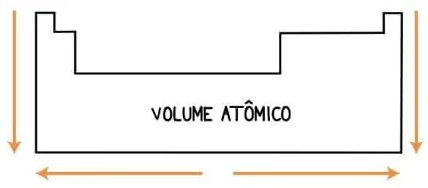
A definição de volume nós já sabemos, é o espaço que algo ocupa. Pois bem, o volume atômico é o volume de um mol de átomos e é medido experimentalmente, então temos o fator interação intra e intermolecular, aí está o motivo de o volume não crescer junto com o raio e mais, ele é dependente de temperatura e pressão. Vamos ver agora como o volume cresce nas condições normais de temperatura e pressão – CNTP – ou e condições próximas.
Leia mais em: Pressão, volume e temperatura: Tudo o que você precisa saber
Numa mesma família, o crescimento acontece de cima para baixo, pois temos o aumento de níveis eletrônicos. Já quando olhamos para os períodos, nos deparamos com o crescimento acontecendo do centro para as extremidades, mas o que faz isso acontecer? No parte I, nós vimos que a afinidade por elétrons cresce da esquerda para a direita e que os átomos da esquerda na tabela desejam doar um ou dois elétrons e os átomos da direita desejam receber esses um ou dois elétrons. E os átomos centrais? Esses não doam ou recebem elétrons, eles acabam compartilhando elétrons entre si, normalmente mais do que apenas um ou dois, para chegar à estabilidade, o que faz com que eles se aproximem e essa aproximação resulta na diminuição do volume desse mol de átomos.
Leia mais em: Lei Volumétrica
3. Densidade
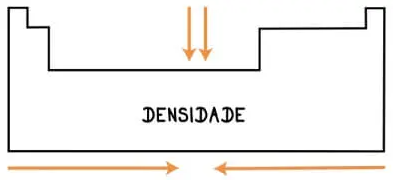
Assim como o volume, a densidade não será uma característica de um átomo, mas sim da junção de um mol de átomos, dada pela razão da massa pelo volume. Como o volume aumento do centro para as extremidades, a densidade diminuirá nesse sentido, portanto, por esta razão, nos períodos, a densidade terá crescimento das laterais para o centro e nas famílias de cima para baixo.
Leia mais em: Densidade
4. Temperaturas de Fusão e de Ebulição
As temperaturas de fusão e ebulição dos elementos nos dizem, respectivamente, quando esses passam do estado sólido para o líquido e do líquido para o gasoso. O que vai determinar essas temperaturas são as interações intermoleculares que, quando mais fortes foram, maiores serão as temperaturas, ou seja, mais energia é necessária para as moléculas irem de um estado em que estão bem próximas para um em que ficarão mais distantes.
O crescimento dessas temperaturas nos período é em direção ao centro da tabela e de cima para baixo nos grupos, com exceção dos dois primeiros, que será de baixo para cima.
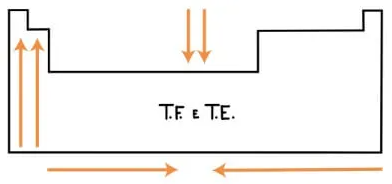
Leia mais em: Temperatura de Fusão e de Ebulição
Gás Nobre, espero que com que este post sobre as Propriedades Periódicas Físicas, além dos posts sobre a História, a Estrutura e as Propriedades Periódicas Químicas da Tabela Periódica você tenha ficado ninja nesse conteúdo e esteja mais do que preparado para mandar super bem em questões sobre este assunto. Reage!
Leia mais em:
Exercícios sobre classificação dos elementos na tabela
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda nesse ano.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


