Fala Gás Nobre, hoje falaremos sobre a distribuição eletrônica, também conhecida por configuração eletrônica, que é a forma como os elétrons dos elementos químicos são ordenados de acordo com sua quantidade e sua proximidade com o núcleo atômico.
Ao longo da história inúmeros cientistas se dedicaram a buscar entender e representar o átomo, o que resultou no surgimento de diversos modelos atômicos, conforme novas partículas fundamentais iam sendo descobertas.
Leia mais em: Partículas Fundamentais
Os modelos atômicos mais atuais são os do físico dinamarquês Bohr (1885-1962) e o do físico austríaco Erwin Schrödinger (1887-1961). No entanto, enquanto o de Schrödinger possui aplicações mais voltadas para o campo da física, mecânica e química quântica, o de Bohr é amplamente aceito e utilizado no ensino de química do ensino médio.
Leia mais em:
O que você precisa saber sobre modelos atômicos
Absorção e Emissão de Luz
O modelo de Bohr previa a organização dos elétrons em camadas ou níveis energéticos. Bohr concluiu que os elétrons se distribuem pelas camadas eletrônicas, então poderiam ser encontrados elétrons mais próximos do núcleo ou mais afastados.
Existem 7 dessas camadas eletrônicas, sendo representadas pelas letras K, L, M, N, O, P e Q, as quais representam cada um dos 7 períodos, isto é, linhas horizontais da tabela periódica. A camada K é a mais próxima do núcleo e consequentemente Q, a mais afastada. Quanto mais afastada do núcleo é a camada, maior é a energia dos elétrons que a ocupam.
Leia mais em:
O que é a tabela periódica e como utilizá-la
A história da tabela periódica
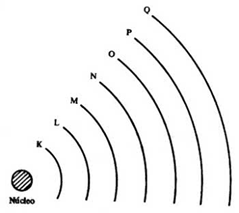
Os elementos que se encontram no mesmo período da tabela periódica apresentam o mesmo número de camadas eletrônicas. Por exemplo, o Cobre (Cu), o Ferro (Fe) e o Níquel (Ni) pertencem ao 4º período da tabela período e todos possuem 4 níveis de energia (camadas eletrônicas).
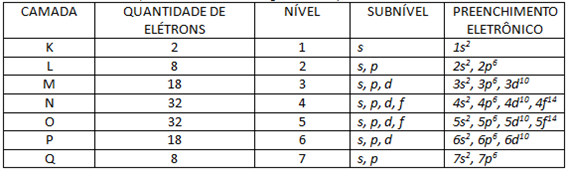
Cada uma dessas camadas eletrônicas possui a capacidade de abrigar um número diferente de elétrons, que variam de 2 a 32 elétrons, dependendo da camada.
A tabela abaixo representa os níveis energéticos, as camadas eletrônicas de cada um desses níveis e o número de elétrons máximo que cada uma dessas camadas é capaz de abrigar.

A última camada eletrônica de um elemento, isto é, a camada mais afastada do núcleo que possui elétrons, é chamada de camada de valência. Segundo a regra do octeto, é nessa camada que ocorrem doação, recebimento ou compartilhamento de elétrons entre átomos em busca da estabilidade eletrônica.
Segundo esta regra, os átomos doam, recebem ou até mesmo compartilham elétrons entre si até atingir o mesmo número de elétrons que os gases nobres possuem na sua última camada, ou seja, 8 elétrons na camada de valência, por isso o nome de regra do octeto. Vale lembrar que os átomos de hidrogênio (H), hélio (He) e lítio (Li) se estabilizam com 2 elétrons, pois sua camada de valência comporta apenas 2 elétrons.
Posteriormente se descobriu que esses níveis de energia se subdividiam em subníveis, representados pelas letras s, p, d, f. De forma análoga as camadas eletrônicas, cada um destes subníveis suporta um número máximo de elétrons.
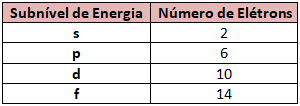
No entanto, observava-se que os elementos do 4º período em diante não possuíam necessariamente suas camadas anteriores completas. Por exemplo, o Ferro (Fe), possui 4 camadas energéticas, tendo 2 elétrons na sua 4ª camada, mas apresenta apenas 14 elétrons na sua 3ª, a capacidade máxima desta camada é de 18 elétrons, ou seja, está incompleta.
Vários cientistas se dedicaram a tentar entender como se dava essa distribuição dos elétrons entre as camadas eletrônicas do átomo. Até que o químico estadunidense Linus Pauling (1901-1994) elaborou um esquema de distribuição eletrônica, que viria a ser chamada do Diagrama de Pauling, enquanto estudava as estruturas atômicas.
Linus Pauling foi um químico quântico e bioquímico, sendo também reconhecido como cristalógrafo, biólogo molecular e pesquisador médico. Pauling foi pioneiro na aplicação da Mecânica Quântica em química, sendo laureado com o Nobel de Química em 1954 em reconhecimento pelo seu trabalho relativo a natureza das ligações químicas.
Desenvolveu importantes trabalhos envolvendo estrutura de proteínas, sendo um dos fundadores da Biologia Molecular. Assim como Rosalind Franklin, esteve perto de descobrir a estrutura de dupla hélice do DNA, sendo esta descoberta atribuída a James Watson e Francis Crick, infelizmente sem o devido reconhecimento as contribuições de Rosalind Franklin.
Pauling recebeu o Nobel da Paz em 1962, pela sua campanha ativa contra os testes nucleares, tornando a única personalidade a ter recebido 2 Prêmio Nobel não compartilhados. Outras personalidades que detém o feito de possuírem 2 destes Prêmio são Marie Curie (Física e Química), John Bardeen (ambos em Física) e Frederick Sanger (ambos em Química).
Leia mais em:
Marie Curie
Marie Curie: Primeira pessoa e única mulher a ganhar o Prêmio Nobel duas vezes
Em seus estudos envolvendo as estruturas atômicas Pauling descobriu uma forma de colocar todos os subníveis de energia em ordem crescente, descobrindo que o preenchimento destes subníveis se dava de forma diagonal, conforme figura abaixo:
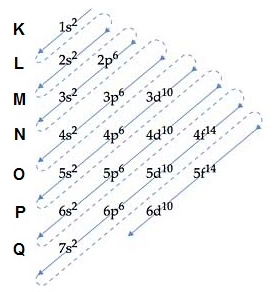
De acordo com o Diagrama de Pauling a ordem de preenchimento dos subníveis das camadas eletrônicas seria:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Desta forma, vamos tomar como exemplo, o 2s²
2 – Indica a camada eletrônica, 2ª camada, L
s – Indica o subnível de energia, s
² – Indica o número de elétrons existentes nesse subnível.
Mas como fazemos a distribuição eletrônica?
Gás Nobre, nas tabelas periódicas é apresentado o número atômico de cada elemento, o número atômico (Z) é o número de prótons que o elemento possui em seu núcleo. O número de prótons que um átomo possui é igual ao número de elétrons dele, logo, pelo número atômico sabemos quantos elétrons os átomos de cada elemento tem.
Vamos tomar como exemplo o Cobre(Cu). O cobre é um elemento do quarto período, ou seja, possui 4 camadas eletrônicas e possui número atômico igual a 29, ou seja, possui 29 elétrons. Vamos realizar a distribuição eletrônica destes 29 elétrons nas suas 4 camadas eletrônicas.
Seguindo o Diagrama de Pauling, vamos preenchendo os subníveis com o número máximo de elétrons que ele comporta até não sobrar mais nenhum elétron. Ao distribuir os 29 elétrons do cobre, preenchemos os subníveis 1s2 2s2 2p6 3s2 3p6 4s2 3d9, ficando o último subnível, 3d10 incompleto com 9 elétrons.
Desta forma, a configuração eletrônica do cobre pode ser representada por:
1s2 2s2 2p6 3s2 3p6 4s2 3d9
Ou
K – 1s²
L – 2s² 2p6
M – 3s² 3p6 3d9
N – 4s²
Se somarmos todos os expoentes dos subníveis chegamos no valor de 29 elétrons:
2+2+6+2+6+2+9 = 29 elétrons
Leia mais em:
Atomística: Entenda tudo sobre o estudo do átomo
Estudo de Moléculas: Um resumo completo
Beleza Gás Nobre, agora é treinar seus conhecimento em distribuição eletrônica com outros elementos da tabela periódica para ficar ninja nesse assunto.
Finalizo este texto com uma tabela contendo o resumo de todas as informações aqui vistas sobre as camadas eletrônicas, seus subníveis, o número de elétrons que cada um comporta e a distribuição eletrônica entre eles. Beleza Gás Nobre? Reage!
–
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciência da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda nesse ano.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciência da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


